Филогенетическое положение и генетические особенности вируса иммунодефицита человека-1 в центральной нервной системе
- Авторы: Питерский М.В.1, Ходаков О.А.1, Михеева Т.В.2, Билалова Н.В.1, Конькова-Рейдман А.Б.2, Захарова Ю.А.3, Семенов А.В.1
-
Учреждения:
- Федеральный научно-исследовательский институт вирусных инфекций «Виром»
- Южно-Уральский государственный медицинский университет
- Федеральный научный центр гигиены имени Ф.Ф. Эрисмана
- Выпуск: Том 101, № 1 (2024)
- Страницы: 100-113
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/16596
- DOI: https://doi.org/10.36233/0372-9311-442
- EDN: https://elibrary.ru/wofnfq
- ID: 16596
Цитировать
Аннотация
Актуальность. Благодаря широкому охвату пациентов с ВИЧ-инфекцией антиретровирусной терапией существенно увеличилась продолжительность жизни инфицированных людей. На фоне снижения смертности от ВИЧ-инфекции высокую важность приобретают ВИЧ-ассоциированные нейрокогнитивные расстройства, которые развиваются даже на фоне эффективного лечения. Общая распространённость такой патологии среди лиц, живущих с ВИЧ, достигает 42,6%.
Целью исследования явилось изучение генетических особенностей и филогенетического положения ВИЧ-1, персистирующего в центральной нервной системе (ЦНС).
Материалы и методы. Обследованы 38 пациентов с тяжёлыми нейрокогнитивными нарушениями на фоне ВИЧ-инфекции в стадии 4В. Вирусную нагрузку ВИЧ-1 определяли в пробах плазмы крови и ликвора с использованием реагентов «АмплиСенс ВИЧ-Монитор-FRT», выполняли секвенирование по Сэнгеру. Филогенетический анализ фрагментов гена pol штаммов ВИЧ-1 (участок, кодирующий вирусную протеазу и часть обратной транскриптазы) проводили методом максимального правдоподобия с моделью замены нуклеотидов GTR+G. Сравнения третичной структуры вирусных белков выполняли на основе трёхмерных моделей протеазы и субъединиц p51 и p66 обратной транскриптазы, полученных методом гомологического построения с использованием сервиса SWISS-MODEL.
Результаты. Уровень вирусной нагрузки в выборке пациентов c тяжёлыми поражениями ЦНС в плазме крови был в 6,27 раза выше, чем в ликворе, и составлял по медиане 4,67 и 3,87 lg копий/мл соответственно (p = 0,004). Филогенетический анализ с использованием всех доступных в GenBank геномов ВИЧ, отличающихся менее чем на 5% от исследуемых штаммов, показал близкое генетическое родство вирусов, циркулирующих в Челябинской области, помимо штаммов из России, со штаммами ВИЧ, циркулирующими в странах ближнего зарубежья, в первую очередь на Украине и в Киргизии, несколько меньше — в Белоруссии, Таджикистане, Казахстане, Армении, а также со штаммами из Польши и Германии. Филогенетический анализ 38 геномов ВИЧ из парных проб (ликвор и плазма крови) позволил выявить у 5 пациентов, 4 из которых являлись потребителями инъекционных наркотиков, существенные генетические дистанции между штаммами ВИЧ, выделенными из ликвора и из плазмы крови, что может свидетельствовать о суперинфицировании разными штаммами.
Количество независимых аминокислотных замен в протеазе у штаммов из плазмы составляло от 1 до 3, у штаммов из ликвора — от 1 до 2, в фрагменте обратной транскриптазы в штаммах из плазмы крови — от 1 до 6, в штаммах из ликвора — от 1 до 7. В штаммах ВИЧ из плазмы и ликвора от 5 пациентов была выявлена разница в структуре субъединицы p51 обратной транскриптазы в аминокислотных позициях 16–20 и 210–235, ещё от 3 пациентов — только в позициях 210–235. В штаммах ВИЧ из плазмы и ликвора от 3 пациентов наблюдалась разница в структуре субъединицы p66 обратной транскриптазы в области связывания с ненуклеозидными ингибиторами обратной транскриптазы. Для появления закрепляющихся различий в третичной структуре субъединицы p51 оказалось достаточно изменения всего 1 аминокислоты. Для изменения третичной структуры субъединицы p66 минимальное количество аминокислотных замен составляло 3.
Заключение. Микроэволюция ВИЧ-1 идёт параллельно в пределах одного пациента в разных компартментах, что отражается в накоплении отличных от другого компартмента аминокислотных замен в консервативном гене pol. Имеется слабая корреляция между уровнем вирусной нагрузки в плазме и в ликворе. Генетическая гетерогенность штаммов ВИЧ от пациентов из Челябинской области свидетельствует о высокой частоте заносов ВИЧ-инфекции в регион из других государств. Различия в третичной структуре обратной транскриптазы ВИЧ-1 между штаммами из плазмы крови и из ликвора закономерно закрепляются в определённых участках, что также подтверждает наличие параллельной микроэволюции ВИЧ в ходе персистирования вируса в тканях, разделённых гематоэнцефалическим барьером, что позволяет лучше понять тенденции закрепления отдельных аминокислотных замен при поражении ЦНС ВИЧ.
Полный текст
Введение
Ассоциированные с ВИЧ нейрокогнитивные расстройства являются широко распространённым явлением среди людей, живущих с ВИЧ/СПИД, несмотря на эффективную антиретровирусную терапию (АРТ). Даже в случае эффективной супрессии вируса в крови его репликация может по-прежнему наблюдаться в спинномозговой жидкости у некоторых пациентов. Это обусловлено тем, что проницаемость гематоэнцефалического барьера (ГЭБ) для различных антиретровирусных препаратов значительно различается и концентрация некоторых препаратов в спинномозговой жидкости не достигает концентраций, необходимых для эффективного подавления репликации ВИЧ [1, 2]. Выявление ВИЧ-инфекции на поздних стадиях приводит к тому, что пациенты уже имеют клинические проявления поражения центральной нервной системы (ЦНС), которые возникают в результате повреждения, вызванного репликацией ВИЧ в ЦНС до начала эффективной АРТ [3–5].
Известно, что ВИЧ, помимо поражения клеток иммунной системы, способен проникать в ЦНС, что приводит к различного рода осложнениям, в том числе к ВИЧ-ассоциированному нейрокогнитивному расстройству (HIV-associated neurocognitive disorder, HAND).
В соответствии с тяжестью симптомов HAND разделяется на три стадии:
- бессимптомное нейрокогнитивное расстройство;
- лёгкое нейрокогнитивное расстройство;
- ВИЧ-ассоциированная деменция [6].
Глобальное метаисследование, проведённое в 2020 г., установило, что общая распространённость HAND по миру составляет 42,6% и различается в зависимости от региона. Наибольшую распространённость HAND имеет в Южной Африке (как и наибольшее количество ВИЧ-положительных лиц) и составляет около 72% от всех случаев в мире. Около 88% всех случаев HAND представлены более мягкими формами (бессимптомное или лёгкое нейрокогнитивное расстройство), в то время как ВИЧ-ассоциированная деменция — довольно редкое явление [7, 8].
Проникновение ВИЧ в ЦНС происходит приблизительно на 4–8-й день после инфицирования, когда человеку, как правило, ещё не поставлен диагноз ВИЧ-инфекция [9]. Вирус проходит через ГЭБ с помощью инфицированных моноцитов и Т-лимфоцитов [10, 11]. Установлено, что содержащие провирус ВИЧ CD14+- и CD16+-моноциты активнее проникают через ГЭБ, чем аналогичные неинфицированные клетки. Важную роль в этом процессе играют адгезивные молекулы JAM-A (junctional adhesion molecule A, или CD321) и ALCAM (activated leukocyte cell adhesion molecule, или CD166). Взаимодействуя с микроваскулярными эндотелиальными клетками ГЭБ, они позволяют моноцитам проникать через него. Их экспрессия существенно увеличивается у инфицированных CD14+- и CD16+-моноцитов. Кроме того, увеличивается количество хемокинов в ЦНС, в частности CCL2, а на поверхности инфицированных CD14+- и CD16+-моноцитов увеличивается количество рецепторов к данному хемокину [12, 13].
Попав в ЦНС, инфицированные моноциты могут дифференцироваться в периваскулярные макрофаги, которые составят устойчивый резервуар для вируса, и будут длительно выделять вирусные частицы, заражая другие клетки ЦНС, такие как макрофаги, астроциты и микроглию, каждые из которых могут тоже выступать в роли резервуара для вируса, даже в условиях продолжительного приёма антиретровирусных препаратов [14]. Инфицированные ВИЧ клетки нервной системы производят вирусные белки, такие как Tat и Nef, что приводит к хроническому воспалению на низком уровне. Причём это воспаление сохраняется даже в условиях приёма антиретровирусных препаратов [15, 16]. Первое известное лонгитюдное исследование среди пациентов с ВИЧ в возрасте 50 лет и старше установило, что приём АРТ и регулярные обследования не могут предотвратить развитие HAND [17].
В ряде исследований установлено, что эволюция ВИЧ-1 в ЦНС идёт параллельно эволюции вируса, остающегося за её пределами [18–20]. Например, белки гена env, штаммов из ликвора приобретают специфические формы, которые взаимодействуют с CD4 и N-концом CCR5 в тандеме, обеспечивая более эффективное проникновение вируса в макрофаги, находящиеся в ЦНС и экспрессирующие малое количество CD4 [21]. Генетические различия между популяциями ВИЧ-1, выделяемыми из плазмы и ликвора, присутствуют и в других генах, таких как tat, nef, pol [22–24]. Мутации, ассоциированные с лекарственной устойчивостью, могут встречаться в штаммах как из плазмы, так и из ликвора, причём в некоторых случаях мутации лекарственной устойчивости могут присутствовать у пациента в штаммах из ликвора и отсутствовать в штаммах из плазмы [25].
Способный к репликации резервуар ВИЧ представляет собой генетически ограниченную и в целом «более молодую» подгруппу общего пула [26]. Стабильность генома ВИЧ тесно связана со структурными особенностями обратной транскриптазы ВИЧ, которая, допуская ошибки при синтезе ДНК ВИЧ, является причиной возникновения мутаций [27].
Обратная транскриптаза ВИЧ-1 представляет собой несимметричный гетеродимер, состоящий из субъединиц p51 (длиной 440 аминокислот) и p66 (длиной 560 аминокислот). Каждая субъединица содержит такие субдомены, как fingers (аминокислоты 1–85, 118–155), palm (аминокислоты 86–117, 156–236), thumb (аминокислоты 237–318), и соединительный субдомен (аминокислоты 319–446). Субъединица p66 также включает в себя субдомен, соединяющий её с РНКазой Н (аминокислоты 427–560). Каталитически активный центр сформирован аминокислотами 110, 185 и 186. Эти две субъединицы имеют различную пространственную организацию, и каталитически активной является только субъединица p66, в то время как p51 играет лишь структурную роль [28].
Изучение различий в трёхмерной структуре протеазы и обратной транскриптазы штаммов ВИЧ, разделённых ГЭБ, представляет интерес для выявления направления адаптационных изменений вируса, связанных с присутствием в определённом компартменте.
Материалы и методы
В период с января 2018 г. по март 2022 г. обследовано 38 ВИЧ-инфицированных пациентов из Челябинской области с нейрокогнитивными расстройствами и тяжёлым иммунодефицитом.
Возраст пациентов в среднем составлял 39 лет (среднее квадратичное отклонение σ = 7, коэффициент Шапиро–Уилка W = 0,917 при p = 0,008). Среди обследованных 20 человек составили мужчины (52,63%; 95% доверительный интервал (ДИ) 37,3–67,5), 18 — женщины (47,37%; 95% ДИ 32,5–62,7). Все пациенты находились на стадии 4В ВИЧ-инфекции. Исследование проводилось при добровольном информированном согласии пациентов. Исследование было одобрено локальным этическим комитетом ФНИИВИ «Виром» (протокол № 2 от 26.05.2022) и локальным этическим комитетом Екатеринбургского НИИ вирусных инфекций (протокол № 3 от 17.06.2016).
Количество CD4-клеток измеряли с помощью проточного цитометра «BD FACSCanto II» и набора реагентов «BD Tritest CD4/CD8/CD3» («Becton Dickinson»). Уровень вирусной нагрузки определяли с использованием набора реагентов «АмплиСенс ВИЧ-Монитор-FRT» (ЦНИИЭ Роспотребнадзора), секвенирование — с использованием набора реагентов «АмплиСенс HIV-Resist-Seq» (ЦНИИЭ Роспотребнадзора). Обработку электрофореграмм и получение консенсусной последовательности осуществляли с помощью программного обеспечения «Деона 1.7.0» («Компания РМБит»).
Всего было получено 57 нуклеотидных последовательностей гена pol ВИЧ-1, в том числе от 19 пациентов — парные образцы из плазмы крови и из ликвора и ещё от 19 пациентов РНК ВИЧ в достаточном для секвенирования количестве удалось выделить или из плазмы крови, или из ликвора. Все нуклеотидные последовательности депонированы в международную базу данных GenBank (Accession numbers: OR260480–OR260536).
Относительно исследуемых нуклеотидных последовательностей был проведён поиск ближайших родственных геномов ВИЧ с помощью сервиса NCBI BLAST [29]. Сформирована коллекция из всех геномов ВИЧ, имеющих сходство с исходными последовательностями 95% и выше (n = 2929). Множественное выравнивание выполняли с помощью алгоритма ClustalOmega на онлайн-сервисе EMBL [30]. Субтипирование, определение мутаций лекарственной устойчивости и прочих мутаций выполняли на сервисе Стэнфордского университета «HIV drug resistance database» («HIVdb Program: Mutations Analysis», версия программы 3.4.3; версия алгоритма 9.4) [31].
Для проведения филогенетического анализа подбор наиболее подходящей для имеющихся данных модели замены нуклеотидов осуществляли с использованием онлайн-сервиса «FindModel» [32]. Филогенетические деревья строили методом максимального правдоподобия с моделью замены нуклеотидов GTR+G (General Time Reversible + gamma) с использованием программного обеспечения «MEGA X» [33]. В качестве меры статистической поддержки использовали 500 бутстреп-репликаций.
Для филогенетического анализа парных образцов генома штаммов ВИЧ, выделенных из плазмы крови и ликвора 19 пациентов, в качестве выборки сравнения добавили геномы ВИЧ, представляющие различные субтипы: A6 (EU861977, KU749403, KT983615, JX500694), B (JX500708) и CRF63_02A6 (JN230353). Указанные штаммы являются референсными для субтипов и циркулирующих рекомбинантных штаммов ВИЧ по версии «Los Alamos HIV databases» [34].
Статистическую обработку данных проводили с помощью программного продукта «Statistica v. 12» («StatSoft Russia»). Расчёт доверительных интервалов осуществляли по методу Уилсона для уровня ошибки 1-го типа 0,05 [35]. Для подтверждения статистически значимого различия использовали критерии непараметрической статистики (χ2, точный критерий Фишера, критерий Манна–Уитни).
Трёхмерные модели вирусных белков (протеазы и обратной транскриптазы) были получены методом гомологического построения. Для протеазы была использована модель кристаллической структуры протеазы ВИЧ-1, субтипа А (PDB ID: 3ixo). Данная модель была выбрана, т.к. она имела наибольшее сходство с нашими аминокислотными последовательностями среди моделей протеаз ВИЧ-1, не связанных с ингибиторами и не имеющих мутации лекарственной устойчивости, а также относилась к наиболее близкому субтипу А.
Для обратной транскриптазы были использованы модель субъединицы p51 обратной транскриптазы ВИЧ-1 (PDB ID: 3kjv) и модель обратной транскриптазы/РНКазы Н ВИЧ-1 (PDB ID: 4icl). Данные модели имеют наибольшее сходство по первичной структуре с нашими последовательностями среди моделей, не находящихся в комплексе с ингибиторами и не имеющих мутаций лекарственной устойчивости.
Построение трёхмерных моделей белков и сравнение их структуры проводили с использованием онлайн-сервиса «SWISS-MODEL» [36, 37].
Результаты и обсуждение
По данным анамнеза пациентов установлено, что продолжительность течения ВИЧ-инфекции с момента установления диагноза до госпитализации составляла в среднем 81 мес (σ = 64; W = 0,924; p = 0,01). Большинство пациентов — 30 из 38 (79,0%; 95% ДИ 63,7–88,9) не имели опыта АРТ, остальные находились на терапии по медиане до 29 мес (межквартильный интервал (МКИ) 9–35 мес), но при этом с низкой приверженностью, самостоятельно прерывая назначенные курсы лечения. Учитывая, что все пациенты были госпитализированы на 4В стадии ВИЧ-инфекции, их заражение произошло задолго до установления диагноза. Таким образом, именно многолетнее течение ВИЧ-инфекции без АРТ обусловило поражение ЦНС.
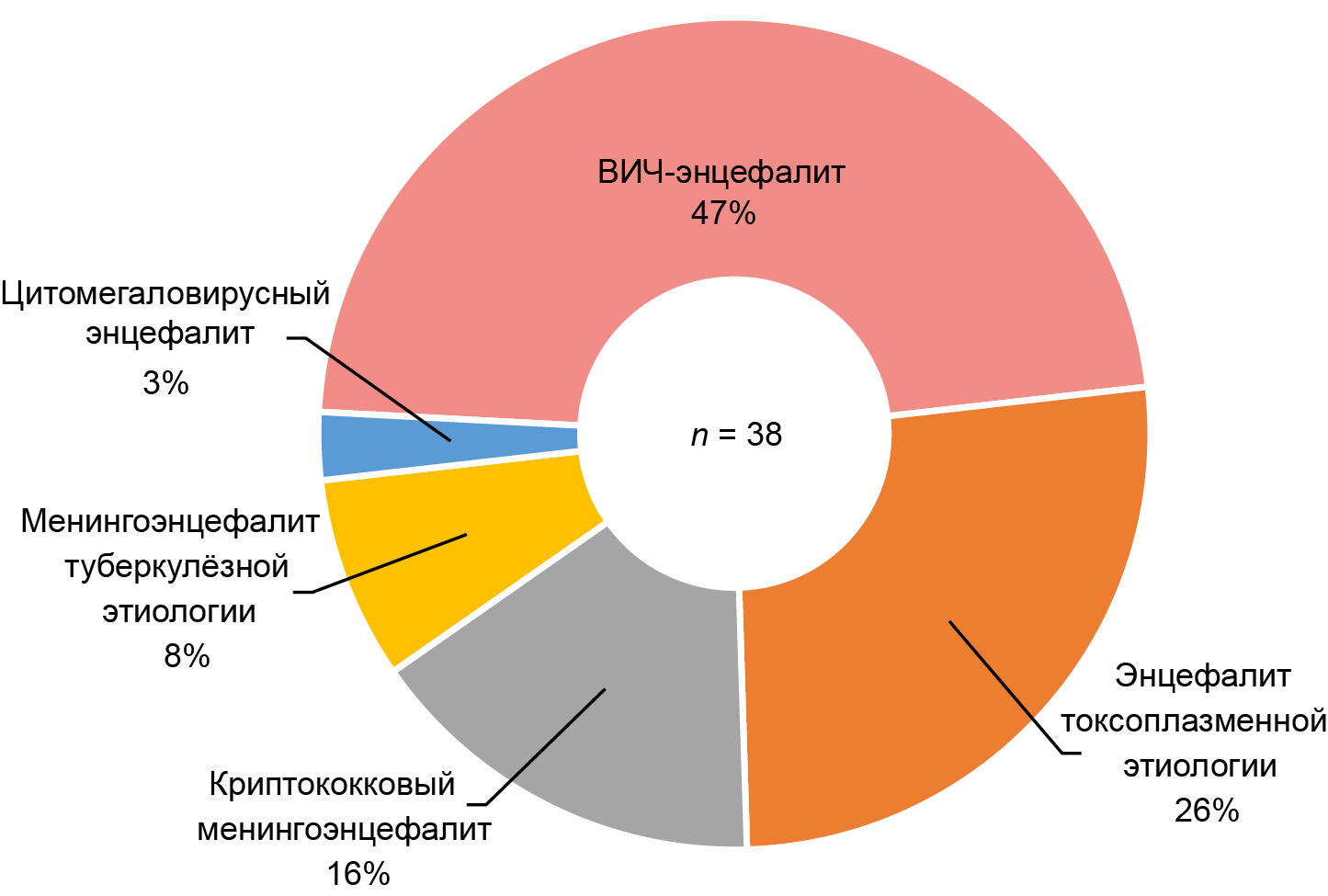
Среди обследованных пациентов (n = 38) наиболее часто встречающимися поражениями головного мозга были менингоэнцефалиты и энцефалиты, связанные с оппортунистическими инфекциями и туберкулёзом, — 20 случаев из 38 (52,6%; 95% ДИ 37,3–67,5), среди которых преобладал энцефалит токсоплазменной этиологии — 10 случаев из 20 (50,0%; 95% ДИ 29,9–70,1). ВИЧ-энцефалит был выявлен в 18 случаях из 38 (47,4%; 95% ДИ 32,5–62,7; рис. 1).
Рис. 1. Структура поражений головного мозга среди обследованных пациентов.
Fig. 1. Structure of brain lesions among the examined patients.
В нашем исследовании группы пациентов с поражениями головного мозга, вызванными оппортунистическими инфекциями, и группа пациентов с ВИЧ-энцефалитом не имели статистически значимых различий по опыту приёма АРТ, полу, возрасту и другим показателям, что могло быть связано с небольшим объёмом выборки. Ранее проведённые исследования показали, что спектр неврологических заболеваний у пациентов с ВИЧ-инфекцией существенно зависит от доступности терапии и её своевременного начала. В странах, где АРТ широко доступна, неврологические симптомы у пациентов с ВИЧ-инфекцией часто обусловлены ВИЧ-энцефалитом. С другой стороны, в развивающихся странах, где доступ к лечению ВИЧ ещё требует улучшения, неврологическое ухудшение часто связано с оппортунистическими инфекциями ЦНС, такими как токсоплазмоз и криптококкоз [38].
Низкое количество CD4 и высокая вирусная нагрузка являются ключевыми факторами, определяющими развитие ВИЧ-энцефалита [39]. Уровень вирусной нагрузки ВИЧ в плазме крови составлял по медиане 4,67 (МКИ 4,19–5,40) lg копий/мл и статистически значимо превышал аналогичный показатель в ликворе, составляющий по медиане 3,87 (МКИ 2,73–4,66) lg копий/мл, на 0,8 lg, или в 6,27 раза (U = 442; z = 2,904; p = 0,004).
Содержание CD4-лимфоцитов в плазме крови составляло по медиане 41,0 (МКИ 21,3–66,5) lg копий/мл, при этом не имело корреляции с уровнем вирусной нагрузки (рис. 2).
Рис. 2. Уровень вирусной нагрузки ВИЧ в плазме крови и ликворе и количество CD4-клеток в выборке обследованных пациентов (n = 19). Пунктиром обозначена медиана.
Fig. 2. HIV viral load in blood plasma and cerebrospinal fluid and an amount of CD4 cells among the examined patients (n = 38). The dotted line indicates the median.
Превышение уровня вирусной нагрузки ВИЧ в ликворе по сравнению с плазмой — достаточно распространённое явление среди пациентов, не получающих эффективной АРТ, и среди АРТ-наивных пациентов, что было также показано в перекрёстном многоцентровом исследовании, проведённом в крупных городах Европы в 1982–2017 гг. [40]. При этом различие в уровне вирусной нагрузки составляло 1,0 lg копий/мл и наблюдалась корреляция между данными показателями в плазме крови и ликворе. В нашем исследовании имелась слабая прямая корреляционная связь между уровнями вирусной нагрузки ВИЧ в плазме крови и ликворе: коэффициент Спирмена Rs = 0,38, p = 0,019.
Среди 57 генотипированных образцов от 38 пациентов выявлены 54 представителя субсубтипа A6 (94,7%; 95% ДИ 85,6–98,2), в 2 образцах от 1 пациента выявлен рекомбинантный штамм CRF63_02A6 (3,5%; 95% ДИ 1,0–11,9) и 1 штамм, выделенный из плазмы, содержал субтип B (1,8%; 95% ДИ 0,3–9,3), притом что штамм, выделенный из ликвора того же пациента, принадлежал к субсубтипу А6 ВИЧ-1.
Для определения филогенетического положения исследуемых штаммов у каждой из 57 последовательностей с помощью сервиса NCBI BLAST найдены геномы ВИЧ, имеющие сходство 95% и выше. После исключения повторяющихся записей, синтетических последовательностей, а также записей, в которых страну происхождения штамма невозможно установить, осталось 2872 нуклеотидных последовательности, имеющие среднюю идентичность по медиане 95,97% (МКИ 95,52–96,51%). Вместе с исследуемыми образцами генотипическая структура была представлена 2508 штаммами субсубтипа А6 (85,5%; 95% ДИ 84,1–86,7), 397 CRF63_02A6 (13,8%; 95% ДИ 12,6–15,1), 14 субтипов B (0,5%; 95% ДИ 0,3–0,8) и 7 CRF02_A6G (0,2%; 95% ДИ 0,1–0,5) среди 2929 анализируемых штаммов.
Филогенетический анализ 2929 фрагментов гена pol ВИЧ-1, кодирующих протеазу и часть ревертазы, проводили по методу максимального правдоподобия с использованием модели замены нуклеотидов GTR+G и 500 бутстреп-репликациями. В результате сформировались 26 кластеров, в 11 из которых вошли 57 штаммов ВИЧ, выделенных от исследуемых пациентов (рис. 3).
Рис. 3. Филогенетическое дерево, построенное методом максимального правдоподобия на основе 2929 фрагментов гена pol ВИЧ-1 (кодирующих протеазу и часть обратной транскриптазы) с не менее чем 95% сходством со штаммами исследуемой выборки.
Fig. 3. Maxim-likehood phylogenetic tree derived from 2929 HIV-1 pol gene (fragment encoding viral protease and part of reverse transcriptase) sequences which had 95% or more identity with studied ones.
Штаммы от пациентов из исследуемой выборки вошли в 11 кластеров. Среди штаммов от пациентов из стран ближнего зарубежья в кластерах с исследуемыми образцами чаще всего оказывались штаммы, циркулирующие на Украине и в Киргизии (по 6 из 11 кластеров), Белоруссии, Таджикистане, Казахстане, Армении (5 из 11 кластеров), среди государств из дальнего зарубежья — в Польше и Германии (5 из 11 кластеров).
Среди 57 штаммов ВИЧ, выделенных от пациентов из исследуемой выборки, 11 (19,3%; 95% ДИ 11,1–31,3) сформировали отдельный кластер № 3, где на их долю пришлось 73,3% (95% ДИ 48–89,1). Данные штаммы были выделены от 8 пациентов, из которых 6 женщин и 1 мужчина из Челябинска и 1 женщина из города Сатка Челябинской области. Из 8 пациентов только 2 заразились при употреблении наркотиков внутривенно, остальные — половым путём.
Большинство родственных штаммов происходили из России (75,4%; 95% ДИ 73,8–76,9). Их доля варьировала от кластера к кластеру от 24% (кластер № 23) до 100% (кластер № 15). Наибольший интерес представляли штаммы, происходившие из иностранных государств.
В самом крупном на филогенетическом дереве кластере № 13, содержащем 873 генома ВИЧ (29,8%; 95% ДИ 28,2–31,5), оказались 16 штаммов от пациентов из исследуемой группы, а также штаммы от пациентов из 19 иностранных государств. Наибольшие доли среди 208 штаммов ВИЧ из иностранных государств в данном кластере пришлись на штаммы, циркулирующие в Киргизии (29,3%), Белоруссии (23,6%), Таджикистане (12,0%).
Филогенетический анализ парных образцов из плазмы крови и ликвора от 19 пациентов с референсами субсубтипа А6, субтипа В и CRF63_02A6 показал, что у 5 пациентов последовательности из плазмы и из ликвора попали в разные кластеры, причём у одного из них штаммы ВИЧ принадлежали к разным субтипам: субтип B — в плазме (ID159, AN: OR260493), субсубтип A6 — в ликворе (ID160, AN: OR260494) (рис. 4).
Рис. 4. Филогенетическое дерево 38 последовательностей гена pol ВИЧ-1 от 19 пациентов, полученных парно из плазмы крови и спинномозговой жидкости. Овалами одного цвета обозначены парные образцы, попавшие в разные кластеры. На ветвях и в кластерах красного цвета размещаются последовательности, принадлежащие к субсубтипу А6 ВИЧ-1.
Fig. 4. Phylogenetic tree of 38 HIV-1 pol gene sequences from 19 patients obtained in pairs from blood plasma and CSF. Ovals of the same color indicate paired samples that have fallen into different clusters. Red branches and clusters contain HIV-1 subtype A6 sequences.
Из 5 пациентов с генетической неоднородностью геномов ВИЧ из различных компартментов 4 являлись потребителями инъекционных наркотиков. Необходимо отметить, что минимальные различия в геноме штаммов ВИЧ из ликвора и плазмы наблюдались у пациента, не являвшегося потребителем инъекционных наркотиков. На филогенетическом дереве с 2929 геномами ВИЧ штаммы от данных пациентов также оказались в различных кластерах. Существенные различия в геноме ВИЧ, персистирующего по разные стороны ГЭБ, может косвенно свидетельствовать о суперинфицировании пациента, при этом из плазмы крови выделяется штамм, заражение которым произошло позднее.
Для анализа аминокислотных замен (АКЗ) и третичной структуры протеазы и ревертазы ВИЧ были отобраны штаммы из парных проб от 13 пациентов из 19. Из сравнения исключены 5 пациентов с высокой гетерогенностью штаммов и подозрением на суперинфицирование и 1 пациент, у которого в штаммах из плазмы и из ликвора аминокислотный состав протеазы и ревертазы совпал полностью.
Сравнительный анализ выявленных АКЗ в протеазе и ревертазе штаммов из плазмы и ликвора 13 пациентов позволил выявить независимо возникшие мутации, которые сформировались и закрепились в процессе микроэволюции штаммов ВИЧ, разделённых ГЭБ. Учитывая крайне тяжёлое состояние пациентов, в отдельных случаях могли наблюдаться максимально возможные изменения в геноме, которые успели произойти за время течения ВИЧ-инфекции у одного человека без АРТ.
В протеазе у штаммов ВИЧ, выделенных из плазмы, только в 5 из 13 образцов были выявлены АКЗ, возникшие независимо (присутствовали только у штаммов из одного компартмента и, соответственно, не унаследованные штаммом, персистирующим в ЦНС) от штаммов, выделенных из ликвора, при этом число АКЗ варьировало от 1 до 3. У штаммов, выделенных из ликвора, независимые АКЗ наблюдались также в 5 из 13 образцов, а их количество варьировало от 1 до 2.
В ревертазе у штаммов, выделенных из плазмы, в 10 из 13 образцов были выявлены АКЗ, возникшие независимо от штаммов, выделенных из ликвора, при этом число АКЗ варьировало от 1 до 6. В 12 образцах из ликвора число независимо возникших АКЗ варьировало от 2 до 7.
При сравнении третичной структуры белков, построенных на основе модели субъединицы p51 обратной транскриптазы ВИЧ, выявлены 2 высоковариабельных участка, имеющих различия между штаммами из плазмы и из ликвора. У штаммов из плазмы и из ликвора от 5 пациентов структуры обратной транскриптазы ВИЧ-1 совпали полностью.
В штаммах из плазмы и из ликвора от других 5 пациентов различия в структуре ревертазы присутствовали в аминокислотных позициях 16–20, что соответствует началу структурного элемента fingers (рис. 5).
Рис. 5. Различия в структуре субъединицы p51 обратной транскриптазы ВИЧ-1 между штаммами из плазмы крови и из ликвора. Чёрной рамкой крупно выделены аминокислотные позиции 16–20. Салатовым цветом обозначен штамм из плазмы, светло-коричневым — из ликвора. Красным выделена аминокислотная позиция 18.
Fig. 5. Difference in the tertiary structure of HIV-1 reverse transcriptase p51 subunit between strains from blood plasma and from CSF. Amino acid positions 16–20 are framed. Strain from blood plasma is shown in cyan, from CSF — in light brown. Amino acid position 18 is highlighted in red.
В конце структурного элемента palm в позициях 210–235 также оказался вариабельный участок, различия в котором между штаммами из плазмы и из ликвора были выявлены в 8 парах образов, включая 5 пар, у которых наблюдалась разница по структуре в позициях 16–20 (рис. 6).
Рис. 6. Различия в структуре субъединицы p51 обратной транскриптазы ВИЧ-1 между штаммами из плазмы крови и из ликвора. Чёрной рамкой крупно выделены аминокислотные позиции 210–235. Салатовым цветом обозначен штамм из плазмы, светло-коричневым — из ликвора. Красным выделена аминокислотная позиция 220.
Fig. 6. Difference in the tertiary structure of HIV-1 reverse transcriptase p51 subunit between strains from blood plasma and from CSF. Amino acid positions 210–235 are framed. Strain from blood plasma is shown in cyan, from CSF — in light brown. Amino acid position 220 is highlighted in red.
В других исследованиях установлено, что участок в области аминокислотных позиций 219–230, формирующий неупорядоченную петлю в субъединице p51 обратной транскриптазы ВИЧ-1, играет важную роль в процессе димеризации 2 субъединиц фермента [41].
При сравнении третичной структуры субъединицы p66 обратной транскриптазы ВИЧ-1 у 10 из 14 пациентов структуры фермента у штаммов из плазмы и из ликвора совпали полностью, ещё у 3 наблюдались закономерно повторяющиеся различия в аминокислотных позициях 187–190 (сразу после каталитически активных позиций 185, 186) (рис. 7).
Рис. 7. Различия в структуре субъединицы p66 обратной транскриптазы ВИЧ-1 между штаммами из плазмы крови и из ликвора. Чёрной рамкой крупно выделены аминокислотные позиции 187–190. Салатовым цветом обозначен штамм из плазмы, светло-коричневым — из ликвора. Красным выделена аминокислотная позиция 187.
Fig. 7. Difference in the tertiary structure of HIV-1 reverse transcriptase p66 subunit between strains from blood plasma and from CSF. Amino acid positions 187–190 are framed. Strain from blood plasma is shown in cyan, from CSF — in light brown. Amino acid position 187 is highlighted in red.
Данная область входит в участок, являющийся местом связывания нуклеозидных ингибиторов обратной транскриптазы (ННИОТ) с ферментом [42].
В результате даже единичных АКЗ в процессе микроэволюции третичная структура ревертазы изменялась, адаптируясь под специфические условия функционирования. Такая адаптация происходила независимо в разных компартментах, разделённых ГЭБ. При этом закрепились только те АКЗ, которые наиболее оптимальны для среды функционирования каждого из штаммов ВИЧ. Анализ АКЗ в субъединицах p51 и p66 ревертазы продемонстрировал их связь с различиями в третичной структуре (таблица).
АКЗ, связанные с различием в третичной структуре обратной транскриптазы (ОТ) штаммов ВИЧ-1 из ликвора и плазмы крови
Amino acid substitutions, associated with HIV-1 reverse transcriptase (RT) tertiary structure alterations in strains from CSF and blood plasma
ID пациента Patient ID | Номер в GenBank Accession number | Локус Locus | АКЗ относительно референсной последовательности HXB2 | Amino acid substitutions relative to HXB2 reference sequence | Различия в третичной структуре субъединицы p51 ОТ в позициях 16–20 | Differences in the tertiary structure of RT p51 subunit in positions 16–20 | Различия в третичной структуре субъединицы p51 ОТ в позициях 210–235 | Differences in the tertiary structure of RT p51 subunit in positions 210–235 | Различия в третичной структуре субъединицы p66 ОТ в позициях 187–190 | Differences in the tertiary structure of RT p66 subunit in positions 187–190 |
p8 | OR260486 | Плазма крови Blood plasma | T69S, Q242K | + | + | |
OR260531 | Ликвор CSF | E6D, K20E, E28K | ||||
p11 | OR260523 | Плазма крови Blood plasma | T39D | + | + | |
OR260482 | Ликвор CSF | T39N | ||||
p26 | OR260512 | Плазма крови Blood plasma | _ | + | + | |
OR260533 | Ликвор CSF | E28K, K64R | ||||
p27 | OR260521 | Плазма крови Blood plasma | K11A, T39K, V60I | + | + | |
OR260480 | Ликвор CSF | K11T, E36D, T39E, K64R | ||||
p53 | OR260516 | Плазма крови Blood plasma | _ | + | ||
OR260535 | Ликвор CSF | K64R, A158S | ||||
p59 | OR260517 | Плазма крови Blood plasma | V35K, T39K, I47M | + | + | |
OR260528 | Ликвор CSF | T39R, K64R, D67N, T200A | ||||
p95 | OR260507 | Плазма крови Blood plasma | E40D, D86N, L214F | + | + | + |
OR260508 | Ликвор CSF | _ | ||||
p96 | OR260509 | Плазма крови Blood plasma | V35T, T39M, S162H | + | ||
OR260510 | Ликвор CSF | V35I, T39K, V60I, S162Y | ||||
p46 | OR260513 | Плазма крови Blood plasma | V35K, F116Y | + | ||
OR260534 | Ликвор CSF | T27P, V35T, S162C, D177N |
Третичная структура субъединицы p51 обратной транскриптазы ВИЧ-1 оказалась наиболее вариабельной, при этом для возникновения конформационных различий между белками штаммов из плазмы крови и ликвора требовалось не менее 2 эволюционных событий, связанных с АКЗ, по 1 в каждом из штаммов. Субъединица p51 каталитически неактивна и играет лишь структурную роль в комплексе обратной транскрипции. Аналогичные АКЗ в субъединице p66 ревертазы, которая и выполняет каталитические функции, не приводили к изменениям в третичной структуре. В 3 случаях различия в третичной структуре субъединицы p66 присутствовали, но были минимальны и охватывали участок длиной 3 аминокислоты. Различия третичной структуры субъединицы p66 ревертазы были связаны как минимум с 3 эволюционными событиями в одном из штаммов или с 5 событиями в штаммах из ликвора и плазмы.
Заключение
Выявлена статистически достоверная слабая корреляция между уровнем вирусной нагрузки ВИЧ в плазме крови и ликворе. Показатель вирусной нагрузки ВИЧ в плазме крови превышал значения в ликворе на 0,8 lg, или в 6,3 раза.
Филогенетический анализ фрагмента гена pol ВИЧ-1, кодирующего протеазу и часть обратной транскриптазы, демонстрирует высокую степень гетерогенности, часть геномов кластеризуются с близкородственными штаммами, циркулирующими как в странах ближнего зарубежья на Украине и в Киргизии, так и в Центральной Европе: Польше и Германии. Это может свидетельствовать о высокой частоте заносов ВИЧ-инфекции в регион из-за рубежа.
Cравнение участков гена pol ВИЧ-1 (кодирующих протеазу и часть обратной транскриптазы) между штаммами из плазмы крови и из ликвора выявило у штаммов от 5 пациентов значительные генетические дистанции между геномами ВИЧ-1 (в 1 случае штаммы принадлежали разным субтипам — А6 в плазме и B в ликворе).
Количество независимых АКЗ в участке, кодирующем вирусную протеазу, у штаммов из плазмы крови составляло от 1 до 3, у штаммов из ликвора — от 1 до 2. Количество АКЗ в участке, кодирующем фрагмент обратной транскриптазы ВИЧ-1, в штаммах из плазмы крови составляло от 1 до 6, а в штаммах из ликвора — от 1 до 7.
Обнаружены высоковариабельные участки в структуре субъединицы p51 обратной транскриптазы ВИЧ-1 в аминокислотных позициях 16–20 и 210–235. У 5 пациентов структура фермента у штаммов из плазмы крови и из ликвора отличалась в обеих позициях, ещё у 4 — только в позициях 210–235. У 3 пациентов третичная структура субъединицы p66 обратной транскриптазы ВИЧ-1 различалась в аминокислотных позициях 187–190. Данная область входит в участок связывания с ННИОТ. Значительно бóльшая разница в третичной структуре наблюдалась в субъединице p51, которая, как известно, не обладает каталитической активностью, однако играет важную структурную роль при формировании комплекса обратной транскрипции.
В третичной структуре вирусной протеазы различий между штаммами из плазмы крови и из ликвора не выявлено.
АКЗ в обратной транскриптазе ВИЧ-1, приводящие к изменениям в третичной структуре одной субъединицы, не обязательно повлекут изменения в другой.
Описанные наблюдения подтверждают наличие микроэволюционного процесса вируса, проявляющегося в изменениях как первичной, так и третичной структур ревертазы ВИЧ, идущего параллельно и независимо в организме одного пациента в разных компартментах, разделённых ГЭБ.
Об авторах
Михаил Валерьевич Питерский
Федеральный научно-исследовательский институт вирусных инфекций «Виром»
Автор, ответственный за переписку.
Email: piterskiy_mv@niivirom.ru
ORCID iD: 0000-0001-5506-2389
SPIN-код: 8756-9549
Scopus Author ID: 57215819806
н.с. Уральского окружного центра по профилактике и борьбе со СПИД Федерального научно-исследовательского института вирусных инфекций «Виром»
Россия, ЕкатеринбургОлег Александрович Ходаков
Федеральный научно-исследовательский институт вирусных инфекций «Виром»
Email: hodakov_oa@niivirom.ru
ORCID iD: 0000-0003-1493-6080
SPIN-код: 4238-4150
м.н.с. Уральского окружного центра по профилактике и борьбе со СПИД Федерального научно-исследовательского института вирусных инфекций «Виром»
Россия, ЕкатеринбургТатьяна Владимировна Михеева
Южно-Уральский государственный медицинский университет
Email: micheeva74@mail.ru
ORCID iD: 0000-0003-3371-9495
зав. 1-го инфекционного отделения Клиники Южно-Уральского медицинского университета
Россия, ЧелябинскНаталья Васильевна Билалова
Федеральный научно-исследовательский институт вирусных инфекций «Виром»
Email: bilalova_nv@niivirom.ru
ORCID iD: 0000-0003-2693-5544
зав. арбитражной лабораторией ВИЧ и оппортунистических инфекций Уральского окружного центра по профилактике и борьбе со СПИД Федерального научно-исследовательского института вирусных инфекций «Виром»
Россия, ЕкатеринбургАлена Борисовна Конькова-Рейдман
Южно-Уральский государственный медицинский университет
Email: konkova-reidman@mail.ru
ORCID iD: 0000-0002-6058-0997
SPIN-код: 2580-8467
д.м.н., профессор каф. инфекционных болезней Южно-Уральского медицинского университета
Россия, ЧелябинскЮлия Александровна Захарова
Федеральный научный центр гигиены имени Ф.Ф. Эрисмана
Email: piterskiy_mv@niivirom.ru
ORCID iD: 0000-0003-3416-0902
д.м.н., проф., научный руководитель Института дезинфектологии Федерального научного центра гигиены им. Ф.Ф. Эрисмана
Россия, МоскваАлександр Владимирович Семенов
Федеральный научно-исследовательский институт вирусных инфекций «Виром»
Email: semenov_av@niivirom.ru
ORCID iD: 0000-0003-3223-8219
SPIN-код: 2372-5134
Scopus Author ID: 56988449300
д.б.н., директор Федерального научно-исследовательского института вирусных инфекций «Виром»
Россия, ЕкатеринбургСписок литературы
- Bleasby K., Castle J.C., Roberts C.J., et al. Expression profiles of 50 xenobiotic transporter genes in humans and pre-clinical species: A resource for investigations into drug disposition. Xenobiotica. 2006;36(10–11):963–88. DOI: https://doi.org/10.1080/00498250600861751
- Ene L., Duiculescu D., Ruta S.M. How much do antiretroviral drugs penetrate into the central nervous system? J. Med. Life. 2011;4(4):432–9.
- Qu Y., Weinstein A., Wang Z., et al. Legacy effect on neuropsychological function in HIV-infected men on combination antiretroviral therapy. AIDS. 2022;36(1):19–27. DOI: https://doi.org/10.1097/QAD.0000000000003071
- Heaton R.K., Ellis R.J., Tang B., et al. Twelve-year neurocognitive decline in HIV is associated with comorbidities, not age: a CHARTER study. Brain. 2023;146(3):1121–31. DOI: https://doi.org/10.1093/brain/awac465
- Ferretti F., Mora-Peris B., Underwood J., et al. Cognitive impairment in a clinical setting. J. Acquir. Immune. Defic. Syndr. 2018;77(1):e10–3. DOI: https://doi.org/10.1097/QAI.0000000000001547
- Antinori A., Arendt G., Becker J.T., et al. Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789–99. DOI: https://doi.org/10.1212/01.WNL.0000287431.88658.8b
- Wang Y., Liu M., Lu Q., et al. Global prevalence and burden of HIV-associated neurocognitive disorder: A meta-analysis. Neurology. 2020;95(19):e2610–21. DOI: https://doi.org/10.1212/WNL.0000000000010752
- Sacktor N. Changing clinical phenotypes of HIV-associated neurocognitive disorders. J. Neurovirol. 2018;24(2):141–5. DOI: https://doi.org/10.1007/s13365-017-0556-6
- Valcour V., Chalermchai T., Sailasuta N., et al. Central nervous system viral invasion and inflammation during acute HIV infection. J. Infect. Dis. 2012;206(2):275–82. DOI: https://doi.org/10.1093/infdis/jis326
- Spudich S., González-Scarano F. HIV-1-related central nervous system disease: current issues in pathogenesis, diagnosis, and treatment. Cold Spring. Harb. Perspect. Med. 2012;2(6):a007120. DOI: https://doi.org/10.1101/cshperspect.a007120
- Eugenin E.A., Osiecki K., Lopez L., et al. CCL2/monocyte chemoattractant protein-1 mediates enhanced transmigration of human immunodeficiency virus (HIV)-infected leukocytes across the blood-brain barrier: a potential mechanism of HIV-CNS invasion and NeuroAIDS. J. Neurosci. 2006;26(4):1098–106. DOI: https://doi.org/10.1523/JNEUROSCI.3863-05.2006
- Veenstra M., León-Rivera R., Li M., et al. Mechanisms of CNS viral seeding by HIV+ CD14+ CD16+ monocytes: establishment and reseeding of viral reservoirs contributing to HIV-associated neurocognitive disorders. mBio. 2017;8(5):e01280–17. DOI: https://doi.org/10.1128/mBio.01280-17
- Yuan L., Qiao L., Wei F., et al. Cytokines in CSF correlate with HIV-associated neurocognitive disorders in the post-HAART era in China. J. Neurovirol. 2013;19(2):144–9. DOI: https://doi.org/10.1007/s13365-013-0150-5
- León-Rivera R., Veenstra M., Donoso M., et al. Central Nervous System (CNS) viral seeding by mature monocytes and potential therapies to reduce CNS viral reservoirs in the cART era. mBio. 2021;12(2):e03633–20. DOI: https://doi.org/10.1128/mBio.03633-20
- Lehmann M.H., Lehmann J.M., Erfle V. Nef-induced CCL2 expression contributes to HIV/SIV brain invasion and neuronal dysfunction. Front. Immunol. 2019;10:2447. DOI: https://doi.org/10.3389/fimmu.2019.02447
- Mediouni S., Darque A., Baillat G., et al. Antiretroviral therapy does not block the secretion of the human immunodeficiency virus Tat protein. Infect. Disord. Drug Targets. 2012;12(1):81–6. DOI: https://doi.org/10.2174/187152612798994939
- Paddick S., Holmes S., Ranasinghe S., et al. HIV‐associated neurocognitive disorders (HAND) in a cART‐treated cohort of adults aged 50 and over in Kilimanjaro, Tanzania: The first longitudinal follow‐up study of HAND in an older population in sub‐Saharan Africa: Neuropsychiatry and behavioral neurology/Dementia. Alzheimer’s & Dementia. 2020;16(S6):e041971. DOI: https://doi.org/10.1002/alz.041971
- Bergroth T., Ekici H., Gisslén M., et al. Difference in drug resistance patterns between minor HIV-1 populations in cerebrospinal fluid and plasma. HIV Med. 2009;10(2):111–5. DOI: https://doi.org/10.1111/j.1468-1293.2008.00659.x
- St. Bernard L., Abolade J., Mohri H., Markowitz M., Evering T.H. Drug resistance mutation frequency of single-genome amplification-derived HIV-1 polymerase genomes in the cerebrospinal fluid and plasma of HIV-1-infected individuals under nonsuppressive therapy. J. Virol. 2020;94(20):e01824–19. DOI: https://doi.org/10.1128/JVI.01824-19
- Nightingale S., Geretti A.M., Beloukas A., et al. Discordant CSF/plasma HIV-1 RNA in patients with unexplained low-level viraemia. J. Neurovirol. 2016;22(6):852–60. DOI: https://doi.org/10.1007/s13365-016-0448-1
- Churchill M., Nath A. Where does HIV hide? A focus on the central nervous system. Curr. Opin. HIV AIDS. 2013;8(3): 165–9. DOI: https://doi.org/10.1097/COH.0b013e32835fc601
- Bavaro D.F., Calamo A., Lepore L., et al. Cerebrospinal fluid compartmentalization of HIV-1 and correlation with plasma viral load and blood–brain barrier damage. Infection. 2019;47(3):441–6. DOI: https://doi.org/10.1007/s15010-019-01268-8
- Bednar M.M., Sturdevant C.B., Tompkins L.A., et al. Compartmentalization, viral evolution, and viral latency of HIV in the CNS.: 2. Curr HIV/AIDS Rep. 2015;12(2):262–71. DOI: https://doi.org/10.1007/s11904-015-0265-9
- Olivieri K.C., Agopian K.A., Mukerji J., Gabuzda D. Evidence for adaptive evolution at the divergence between lymphoid and brain HIV-1 nef genes. AIDS Res. Hum. Retroviruses. 2010;26(4):495–500. DOI: https://doi.org/10.1089/aid.2009.0257
- Gega A., Kozal M.J., Chiarella J., et al. Deep sequencing of HIV-1 variants from paired plasma and cerebrospinal fluid during primary HIV infection. J. Virus Erad. 2015;1(4): 264–8.
- Shahid A., MacLennan S., Jones B.R., et al. The replication-competent HIV reservoir is a genetically restricted, younger subset of the overall pool of HIV proviruses persisting during therapy, which is highly genetically stable over time. J Virol. 2024;98(2):e0165523. doi: 10.1128/jvi.01655-23
- Hu W.S., Hughes S.H. HIV-1 reverse transcription. Cold Spring Harb. Perspect. Med. 2012;2(10):a006882. DOI: https://doi.org/10.1101/cshperspect.a006882
- Singh A.K., Das K. Insights into HIV-1 Reverse Transcriptase (RT) inhibition and drug resistance from thirty years of structural studies. Viruses. 2022;14(5):1027. DOI: https://doi.org/10.3390/v14051027
- Madden T. Chapter 16. The BLAST sequence analysis tool. In: The NCBI Handbook. National Center for Biotechnology Information (US); 2003.
- Madeira F., Pearce M., Tivey A.R.N., et al. Search and sequence analysis tools services from EMBL-EBI in 2022. Nucleic Acids Res. 2022;50(W1):W276–9. DOI: https://doi.org/10.1093/nar/gkac240
- Liu T.F., Shafer R.W. Web resources for HIV type 1 genotypic-resistance test interpretation. Clin. Infect. Dis. 2006;42(11): 1608–18. DOI: https://doi.org/10.1086/503914
- Posada D., Crandall K.A. MODELTEST: testing the model of DNA substitution. Bioinformatics. 1998;14(9):817–8. DOI: https://doi.org/10.1093/bioinformatics/14.9.817
- Kumar S., Stecher G., Li M., et al. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms. Mol. Biol. Evol. 2018;35(6):1547–9. DOI: https://doi.org/10.1093/molbev/msy096
- Apetrei C., Hahn B., Rambaut A., et al. HIV Sequence Compendium 2021. Los Alamos,New Mexico; 2021. URL: https://www.hiv.lanl.gov/content/sequence/HIV/COMPENDIUM/2021/sequence2021.pdf
- Wilson E.B. Probable inference, the law of succession, and statistical inference. J. Am. Stat. Association. 1927;22(158):209–12. DOI: https://doi.org/10.2307/2276774
- Guex N., Peitsch M.C., Schwede T. Automated comparative protein structure modeling with SWISS-MODEL and Swiss-PdbViewer: a historical perspective. Electrophoresis. 2009;30(Suppl. 1):S162–73. DOI: https://doi.org/10.1002/elps.200900140
- Waterhouse A., Bertoni M., Bienert S., et al. SWISS-MODEL: homology modelling of protein structures and complexes. Nucleic Acids Research. 2018;46(W1):W296–303. DOI: https://doi.org/10.1093/nar/gky427
- Daliparty V.M., Balasubramanya R. HIV Encephalitis. Treasure Island (FL): StatPearls Publishing; 2023.
- Jagtap S.B., Patil P.M. Clinical profile of neurological manifestations and CD4 counts in patient living with HIV cases and its outcome with treatment with ART at a tertiary hospital. MedPulse International Journal of Medicine. 2021;21(3):78–84. DOI: https://doi.org/10.26611/10212033
- Ulfhammer G., Edén A., Antinori A., et al. Cerebrospinal fluid viral load across the spectrum of untreated human immunodeficiency virus type 1 (HIV-1) infection: a cross-sectional multicenter study. Clin. Infect. Dis. 2022;75(3):493–502. DOI: https://doi.org/10.1093/cid/ciab943
- London R.E. HIV-1 Reverse transcriptase: a metamorphic protein with three stable states. Structure. 2019;27(3):420–6. DOI: https://doi.org/10.1016/j.str.2018.11.011
- Sarafianos S.G., Marchand B., Das K., et al. Structure and function of HIV-1 reverse transcriptase: molecular mechanisms of polymerization and inhibition. J. Mol. Biol. 2009;385(3): 693–713. DOI: https://doi.org/10.1016/j.jmb.2008.10.071
Дополнительные файлы