Изучение гуморального и клеточного иммунитета при иммунизации мышей линии C57Bl/6 прототипом инактивированной вакцины Чикунгунья
- Авторы: Отрашевская Е.В.1, Каа К.В.2, Оксанич А.С.1, Мурашко Н.В.1, Куслий А.Г.3, Красько А.Г.4, Зверев В.В.1, Игнатьев Г.М.1
-
Учреждения:
- Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
- Федеральный научный центр исследования и разработки иммунобиологических препаратов имени М.П. Чумакова
- «Вектор-Биальгам»
- Республиканский научно-практический центр эпидемиологии и микробиологии
- Выпуск: Том 101, № 2 (2024)
- Страницы: 193-207
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/16587
- DOI: https://doi.org/10.36233/0372-9311-436
- EDN: https://elibrary.ru/qlerjf
- ID: 16587
Цитировать
Аннотация
Введение. Вирусная инфекция Чикунгунья является проблемой для системы здравоохранения эндемичных для этой инфекции регионов из-за отсутствия специфической профилактики и эффективных противовирусных препаратов. Доказана критическая роль клеточного иммунитета для контроля и клиренса вируса при лихорадке Чикунгунья. Эффективная стимуляция не только гуморального, но и клеточного иммунитета имеет неоспоримое значение при оценке эффективности потенциальной вакцины для профилактики данной инфекции.
Цель настоящей работы — изучение формирования протективного иммунитета после введения мышам линии C57Bl/6 препарата, содержащего инактивированный вирус Чикунгунья (ЧИКВ).
Материалы и методы. ЧИКВ (концентрации 10 и 40 мкг) вводили мышам внутримышечно дважды с интервалом 14 дней. Показатели гуморального иммунитета оценивали в иммуноферментном анализе и реакции нейтрализации, клеточного — по продукции интерферона-γ и пролиферации спленоцитов in vitro. Концентрацию цитокинов (интерлейкина-1, -2, -6, -10, -12p70 и фактора некроза опухоли) определяли методом иммуноферментного анализа. При оценке протективной активности животным в дорсальную поверхность стопы правой задней лапы вводили ЧИКВ в дозе 2,89 ± 0,10 lg ТЦД50 в объёме 20 мкл.
Результаты. Наиболее выраженный иммунный ответ отмечен на введение 40 мкг инактивированного ЧИКВ, что проявлялось в сбалансированной продукции исследованных цитокинов, формировании специфического гуморального и клеточного иммунитета. При оценке протективности отёк стопы у иммунизированных животных был достоверно ниже, чем у животных контрольной группы.
Обсуждение. Инактивированный бета-пропиолактоном ЧИКВ обладал выраженными иммуногенными свойствами. Баланс продукции про- и противовоспалительных цитокинов, а также Th1/Th2-иммунного ответа характеризовал формирование адаптивного иммунитета у мышей без выраженной воспалительной реакции. Продемонстрировано формирование специфического гуморального и клеточного иммунного ответа. Исследование протективности в нелетальной модели животных подтвердило эффективность инактивированного препарата.
Заключение. Двукратное введение мышам линии C57Bl/6 инактивированного препарата ЧИКВ в дозе 40 мкг продемонстрировало иммуногенность, что позволяет оценить его как перспективный профилактический препарат.
Полный текст
Введение
Глобальное внимание в последние десятилетия уделяется исследованиям вируса Чикунгунья (ЧИКВ) из-за его широкого географического распространения: страны Азии, страны Океании, Африка, Северная, Центральная и Южная Америка. Вирусная инфекция Чикунгунья является проблемой для системы общественного здравоохранения эндемичных для этой инфекции регионов из-за отсутствия специфической профилактики, а также эффективных противовирусных препаратов. В 2004–2009 гг. внезапная эпидемия лихорадки Чикунгунья затронула 31 млн человек на полуострове Индостан [1, 2]. В 2013 г. ЧИКВ из нескольких стран Карибского бассейна быстро распространился в 45 странах Северной, Центральной и Южной Америки [3]. Летальность при лихорадке Чикунгунья невысокая, преимущественно среди новорождённых, а также пациентов с хроническими заболеваниями сердечно-сосудистой, дыхательной и нервной систем [1, 4]. Однако поражения скелетно-мышечной системы (артриты и артралгии) при лихорадке Чикунгунья нередко приводят к длительной утрате трудоспособности. Причиной артритического поражения суставов являются иммунно-опосредованные механизмы, запускающиеся выраженной продукцией провоспалительных медиаторов. Считается, что перенесённая инфекция ЧИКВ обеспечивает пожизненный иммунитет, повторные случаи инфицирования практически не регистрируются [5, 6]. Этот фактор, наряду с отсутствием специфической терапии как самой инфекции, так и её последствий, делает вакцинацию наиболее перспективным путём профилактики лихорадки Чикунгунья. Также следует учитывать, что, помимо населения эндемичных по ЧИКВ стран, имеется контингент путешественников и специалистов, посещающих или работающих в эндемичных странах, но также существует риск появления эндемичных для ЧИКВ регионов и в развитых странах из-за изменения климата и других непредвиденных факторов, которые могут способствовать появлению и распространению инфекции. Тот факт, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США и Европейское медицинское агентство предоставили статус препарата «для быстрого продвижения и приоритета» (Fast Track/Priority Medicine) для нескольких кандидатных вакцин для профилактики заболевания, вызванного ЧИКВ, подтверждает актуальность проблемы и задачи по выводу на рынок эффективных препаратов для профилактики лихорадки Чикунгунья1.
В 2023 г. в FDA была зарегистрирована вакцина Ixchiq (VLA1553) компании «Valneva»2, разработанная на основе аттенуированного штамма ЧИКВ с делецией генов неструктурных белков [4]. Ряд потенциальных вакцин-кандидатов был протестирован на моделях животных в доклинических испытаниях (ДКИ), а также на людях в ходе клинических исследований [4, 7]. На данном этапе завершена I стадия клинических исследований3 инактивированной вакцины, разработанной индийскими учёными, которая показала достаточную иммуногенность на лабораторных животных [8]. Однако на рынке не зарегистрирована ни одна инактивированная вакцина для профилактики лихорадки Чикунгунья, что делает задачу её разработки актуальной. Технология производства инактивированных вакцин является традиционной и успешной для большого количества вирусных вакцин. Данная технологическая платформа считается одной из наиболее безопасных [4, 8–11], и разработка препарата не требует генетических манипуляций с вирусом. В небольших сравнительных исследованиях на мышах линии BALB/c продемонстрировано преимущество инактивированного бета-пропиолактоном препарата антигена ЧИКВ над формалин-инактивированным препаратом в формировании специфического гуморального и клеточного иммунитета [8, 9]. Ранее был продемонстрирован дозозависимый эффект формирования гуморального и клеточного иммунитета у мышей BALB/c на введение инактивированного бета-пропиолактоном антигена ЧИКВ [11].
Для приготовления экспериментального инактивированного препарата для профилактики лихорадки Чикунгунья на этапе наработки вируса нами были использованы гетероплоидные клетки линии 4647. Данная линия клеток получена в 1974 г. из почек взрослой зелёной мартышки. Созданный в 1983 г. банк клеток линии 4647 прошёл национальное лицензирование и на данном этапе полностью удовлетворяет рекомендациям Всемирной организации здравоохранения. Данная линия клеток получила разрешение для использования в производстве инактивированных вакцин [12]. Ранее была продемонстрирована возможность культивирования клеток 4647 на микроносителях в биореакторах [13]. В нашей стране зарегистрирована и производится вакцина для профилактики гепатита А «Альгавак М», в производстве которой используется данная линия клеток («Вектор-БиАльгам»). Также была показана высокая чувствительность линии клеток 4647, наряду с линией клеток Vero, к ЧИКВ [14].
Иммуногенность вакцин-кандидатов против ЧИКВ оценивается разработчиками не только с точки зрения формирования гуморального иммунитета, в виде «золотого стандарта» нейтрализующей активности специфических поствакцинальных антител (АТ), но и с точки зрения формирования клеточного иммунитета, который крайне важен для клиренса вируса при лихорадке Чикунгунья [4, 8, 10]. Для экспериментального изучения лихорадки Чикунгунья основной моделью являются низшие приматы, т.к. они являются естественными хозяевами ЧИКВ в природе и патогенез заболевания имеет сходную с человеком картину. В качестве лабораторных животных на этапах ДКИ используют белых мышей различных линий. Взрослые иммунодефицитные мыши, как, например, мыши AG129, используются для моделирования летальной инфекции, а для нелетальной модели используются иммунокомпетентные мыши линии C57Bl/6, Swiss albino или BALB/c. Ранее J. Gardner и соавт. описали нелетальную модель инфекции ЧИКВ, при которой у мышей линии C57Bl/6 развивались симптомы, схожие с поражением суставов у человека, а также развитием вирусемии в течение 4–5 дней. При заражении ЧИКВ в дорсальную сторону стопы, у мышей линии C57Bl/6 развивался периметадорсальный отёк с максимумом на 3–7-е сутки, также отмечалось развитие артрита, тендинита и фасциита, что подтверждалось гистологическими данными острого и персистирующего воспаления [15, 16]. Данная модель нередко используется для оценки протективности разрабатываемых вакцинных препаратов против ЧИКВ [17–20]. Нами также была проведено заражение мышей в стопу для оценки протективности инактивированного препарата для профилактики лихорадки Чикунгунья. Для оценки иммуногенности кандидатной инактивированной вакцины мы изучали гуморальный и клеточный иммунитет у мышей линии C57Bl/6 после двукратной иммунизации разными дозами препарата, а также протективность препарата in vivo. Поскольку нормальное функционирование иммунной системы строится на балансе Th1 и Th2, основанном на продукции ими регуляторных цитокинов, мы дополнительно изучали концентрацию отдельных цитокинов в сыворотке иммунизированных животных в динамике.
Целью работы было изучение формирования протективного иммунитета после введения мышам линии C57Bl/6 препарата, содержащего ЧИКВ.
Материалы и методы
В экспериментах был использован штамм Nika2021, полученный из коллекции вирусов филиала СПбНИИВС ФМБА России в Никарагуа. Методика изоляции и пассирования штамма ЧИКВ описана ранее [21]. Нуклеотидная последовательность штамма ЧИКВ Nika2021 представлена в GenBank, acc.no OQ320495.
Клетки линии 4647 (производственный банк «Вектор-БиАльгам») культивировали в среде Игла МЕМ («БиолоТ») с 5% эмбриональной телячьей сывороткой («БиолоТ»).
В исследовании использовали мышей линии C57Bl/6 (гаплотип Н-2b) обоего пола массой 12–14 г. Животные были получены из питомника «Столбовая» Научного центра биомедицинских технологий ФМБА. Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с «Consensus Author Guidelines for Animal Use» (IAVES, 23.07.2010). Протокол исследования одобрен Этическим комитетом НИИВС им. И.И. Мечникова (протокол № 6 от 04.04.2023).
Препарат
Наработку штамма Nika2021 ЧИКВ проводили в линии клеток 4647 при роллерном культивировании, используя множественность заражения 0,0001 TЦД50 на клетку. Инактивация осуществлялась бета-пропиолактоном (в соотношении 1 : 1000) при постоянном перемешивании в течение 48 ч при 5оС. Инактивированная вируссодержащая жидкость была сконцентрирована в 50 раз методом ультрафильтрации (концентратор «Vivaflow 100» («Sartorius»). Для очистки инактивированного вирусного концентрата использовали метод эксклюзионной хроматографии (сорбент Sepharose-6FF («GE Healthcare»). Контроль полученного препарата ЧИКВ осуществляли по показателям: стерильность, рН, отсутствие эндотоксинов, содержание остаточной ДНК клеток 4647 согласно методам, изложенным в Государственной фармакопее4. Препарат стерилен, эндотоксины отсутствовали, содержание остаточной ДНК клеток 4647 < 5 нг/мл, рН 7,4. Концентрацию инактивированного ЧИКВ определяли методом иммуноферментного анализа (ИФА), используя набор «БиоСкрин-Чикунгунья (Ag)» («Биосервис»). Полученный инактивированный препарат в концентрациях 10 и 40 мкг антигена был сорбирован на гидроксиде алюминия (Al(OH)3, «Brenntag SE»). Содержание Al(OH)3 в конечной дозе препарата составляло 0,5 мг на дозу (0,5 мл). Дозы 10 и 40 мкг были использованы в связи с тем, что ранее этими дозами иммунизировали мышей линии BALB/c (гаплотип Н-2d) и оценивали содержание специфических АТ в сыворотке крови в динамике [14]. В указанных экспериментах доза препарата, содержащего 10 мкг антигена ЧИКВ, при двукратном введении вызывала незначительный (минимальный) подъём специфических АТ в группе животных после 2-й иммунизации с падением к 35-му дню наблюдения. В сыворотке животных, привитых дважды дозой 40 мкг антигена ЧИКВ, уже через 7 дней после первой иммунизации отмечался подъём специфических АТ, которые сохранялись до 35-го дня [14].
В связи с имеющимися данными для проводимого исследования были выбраны те же концентрации антигена. В качестве препарата контроля использовали Al(OH)3 в концентрации 0,5 мг на объём введения (0,5 мл).
Методы исследования
ИФА определения титра АТ (IgG) к ЧИКВ проводили, как описано ранее [14]. Образцы тестируемых сывороток разводили 1 : 200 и далее шагом «2» до 1 : 12 800 в фосфатно-солевом буфере (ФСБ). Каждое разведение сыворотки оценивали в 3 повторах. Положительным считалось разведение сыворотки, которое превосходило более чем в 2 раза показатель фона. В качестве отрицательного контроля использовалась сыворотка, полученная от мышей до иммунизации.
Реакцию нейтрализации (РН) проводили, как описано ранее [11], на 96-луночных планшетах с использованием культуры клеток Vero и штамма Nica2021 в дозе 100 ТЦД50. Полученный результат переводили в log2 для статистической обработки.
Исследование пролиферативной активности спленоцитов осуществляли фотометрическим методом по ранее описанной методике [14, 25]. Для стимуляции пролиферативной активности спленоцитов использовали следующие антигены: антиген ЧИКВ, инактивированный бета-пропиолактоном (5 мкг/мл); антиген вируса гепатита А (ВГА), используемый для производства вакцины «Альгавак-М» (5 мкг/мл), а также следующие митогены: конканавалин А (КонА; «ICN»; 5 мкг/мл) и липополисахарид (ЛПС) Salmonella typhimurium («Sigma»; 5 мкг/мл). Каждый антиген и митоген использовали для стимуляции спленоцитов животных in vitro в 4 повторах. ФСБ использовали в качестве контроля.
Определение продукции интерферона-γ (ИФН-γ) спленоцитами мышей in vitro. Спленоциты мышей были помещены в лунки 24-луночных планшетов в концентрации 2 × 106 клеток/мл. К клеткам добавляли антигены ЧИКВ и ВГА в концентрациях 5 мкг/мл для стимуляции продукции ИФН-γ. В качестве положительного контроля стимуляции продукции ИФН-γ использовали КонА («ICN»; 5 мкг/мл), в качестве «отрицательного» контроля использовали ФСБ. Клетки культивировали в течение 48 ч в условиях 5% СО2 при 37ºС. По окончании культивирования собирали культуральную жидкость активированных и контрольных клеток и определяли концентрацию ИФН-γ, используя набор для мышей («R&D Systems»).
Определение концентрации цитокинов в сыворотке крови мышей — интерлейкинов ИЛ-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, ИЛ-12p70, а также фактора некроза опухоли-α (ФНО-α), ИФН-γ — проводили с использованием наборов для мышей («R&D Systems») согласно прилагаемым инструкциям.
Для оценки протективности проводили тест, как описано ранее [15]. Животным в дорсальную поверхность стопы правой задней лапы вводили ЧИКВ в дозе 2,89 ± 0,10 lg ТЦД50 в объёме 20 мкл. Для контроля специфичности отёка в стопу задней левой лапы вводили 20 мкл 0,9% раствора для инфузий NaCl. Степень периметадорсального отёка оценивали на 6-й день. После измерений высоты и ширины электронным штангенциркулем в месте максимального отёка обеих стоп задних лап рассчитывали индекс отёка (ширина × высота заражённой стопы/ширина × высоты противоположной стопы). Для оценки вирусемии после заражения в сыворотке мышей определяли биологическую активность ЧИКВ путём титрования вируса в клетках линии Vero [14]. Результат титрования учитывали по выраженному цитопатическому действию и рассчитывали показатель тканевой цитопатической дозы, вызывающей гибель 50% клеток (ТЦД50), по методу Кербера в модификации Ашмарина и выражали его в lg ТЦД50/мл [23].
Статистический анализ полученных данных проводили с использованием стандартного пакета программ «Microsoft Office Excel 2016». Данные представлены в виде среднего значения (М) и стандартного отклонения среднего (SD), где это было приемлемо. Достоверность различий сравниваемых величин оценивали с помощью t-критерия Стьюдента непарного, с двумя хвостами распределения (t-test). Различия считали статистически достоверными при уровне значимости р < 0,05.
Дизайн исследования
Животные были разделены на группы:
- группа A — 100 мышей, иммунизированных препаратом в дозе 40 мкг/0,5 мл на 0-е и 14-е сутки эксперимента;
- группа B — 100 мышей, иммунизированных препаратом в дозе 10 мкг/0,5 мл на 0-е и 14-е сутки эксперимента;
- группа C — 100 мышей, которым внутримышечно был введён препарат Al(OH)3 на 0-е и 14-е сутки эксперимента.
Препарат вводили в бедренную мышцу внутримышечно, разделив 1 дозу на 2 введения, по 0,25 мл препарата в каждую конечность.
Животных наблюдали до 35 сут (21-е сутки после 2-й иммунизации). По 5 животных из каждой группы на 0-е сутки (до иммунизации), 14-е (до 2-й иммунизации), 21, 28 и 35-е сутки после начала иммунизации использовали для сбора образцов крови, которые были пулированы для дальнейшего определения содержания АТ двумя методами. У этих же животных выделяли селезёнку для дальнейшего получения суспензии спленоцитов. Спленоциты использовали в исследованиях пролиферативной активности и продукции ИФН-γ по методикам, описанным выше. Ещё у 5 животных из каждой группы на 0, 1, 3, 5, 7, 9, 14, 15, 17, 19, 21, 28 и 35-е сутки наблюдения производили забор крови из ретроорбитального синуса глаза и собирали индивидуальные образцы крови для последующего определения профиля цитокинов. Все образцы сыворотки крови после центрифугирования разливали по пробиркам в объёме 200 мкл и хранили при –70ºС для последующего одномоментного исследования. Также на 35-е сутки 10 оставшихся мышей из каждой группы были использованы для оценки протективности кандидатного препарата в нелетальной модели, описанной ранее [15].
Все процедуры на отдельных мышах проводили вне визуального, аудиального или обонятельного контакта с другими животными. Работу с животными проводили в соответствии с Международными принципами «Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей» ETS № 123 (Страсбург, 1986) и Решения Совета Евразийской экономической комиссии от 03.11.2016 № 81 «Об утверждении правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств».
Результаты
Гуморальный иммунитет
Доза препарата, содержащего 10 мкг антигена ЧИКВ, вызывала незначительный и кратковременный подъем специфических АТ в ИФА после 2-й иммунизации животных группы «В» (табл. 1). В этой группе животных максимальный уровень специфических АТ был в 4 раза ниже аналогичного в группе животных группы А. Введение препарата, содержащего 40 мкг антигена ЧИКВ, животным группы А привело к формированию достаточно высокого уровня специфических АТ на 14-й день после 1-й иммунизации, который вырос ещё в 4 раза после 2-й вакцинации к концу срока наблюдения (табл. 1).
Таблица 1. Показатели специфического гуморального иммунитета у мышей линии C57Bl/6, иммунизированных препаратом с разным содержанием антигена ЧИКВ
Table 1. Specific humoral immunity indices in C57Bl/6 mice immunized with the preparation contained different CHIKV antigen dose
Группа Group | РН, log2 NT, log2 | ИФА IgG, титр ELISA IgG, titer | РН, log2 NT, log2 | ИФА IgG, титр ELISA IgG, titer | РН, log2 NT, log2 | ИФА IgG, титр ELISA IgG, titer | РН, log2 NT, log2 | ИФА IgG, титр ELISA IgG, titer | РН, log2 NT, log2 | ИФА IgG, титр ELISA IgG, titer |
0-е сутки (1-я иммунизация) 0 day (1st immunization) | 14-е сутки (2-я иммунизация) 14th day (2nd immunization) | 21-е сутки 21st day | 28-е сутки 28th day | 35-е сутки 35th day | ||||||
А | Н. о. N. d. | Н. о. N. d. | 4,80 ± 0,14* | 1 : 1600** | 5,45 ± 0,15* | 1 : 3200** | 6,84 ± 0,18* | 1 : 6400** | 6,80 ± 0,38* | 1 : 6400** |
В | Н. о. N. d. | Н. о. N. d. | 2,16 ± 0,18 | 1 : 200 | 2,20 ± 0,18 | 1 : 400 | 3,12 ± 0.10 | 1 : 400 | 2,20 ± 0,10 | 1 : 200 |
С | Н. о. N. d. | Н. о. N. d. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Примечание. *р < 0,01, **р < 0,001 по сравнению с группой В. Н. о. — не определяли. Забор крови для контроля специфического иммунитета на 0-е и 14-е сутки у животных проводили до вакцинации.
Note. *р < 0.01, **р < 0.001 in comparison with group В. N. d. — not detected. Animals were bled on days 0 and 14 for the specific immunity testing before antigen administration.
В обеих группах вируснейтрализующие АТ были зарегистрированы на 14-й день после 1-й вакцинации и достигли максимальных значений после 2-й вакцинации (табл. 1). У животных группы В вируснейтрализующие АТ во всём периоде наблюдения были достоверно ниже (p < 0,01) показателя в группе животных А. В сыворотке животных группы С ни в одном из методов АТ не определялись.
Клеточный иммунитет
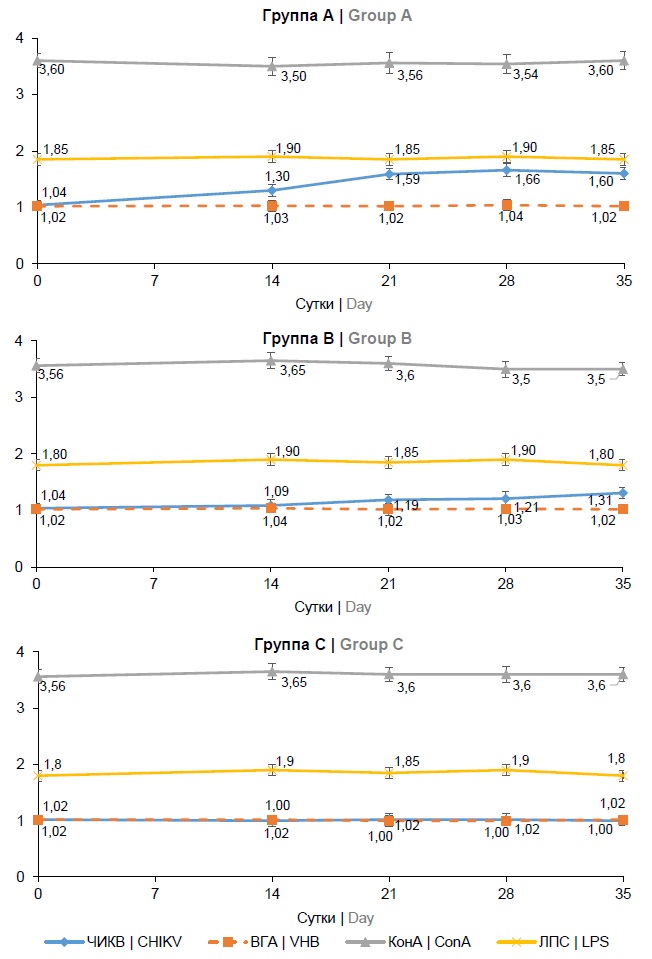
Влияние иммунизации инактивированным препаратом антигена ЧИКВ на формирование специфического клеточного ответа оценивали в реакции пролиферации спленоцитов и в продукции ИФН-γ после стимуляции антигенами. Использованные вирусные антигены (специфический ЧИКВ и гетерологичный ВГА) не вызывали подавления пролиферации спленоцитов in vitro на день «0» (рис. 1).
Рис. 1. Динамика индекса пролиферативной активности спленоцитов мышей линии C57Bl/6, иммунизированных препаратом с разным содержанием антигена ЧИКВ.
Fig. 1. Proliferative activity of splenocytes from C57Bl/6 mice immunized with the preparation contained different CHIKV antigen dose in dynamics. ConA — Conkanavalin A; LPS — lipopolysaccharide.
В ответ на стимуляцию митогенами (КонА и ЛПС) спленоцитов животных всех групп отмечена выраженная пролиферация, которая достоверно превосходила таковую при использовании вирусных антигенов во все сроки наблюдения (р < 0,05). Индекс стимуляции (ИС) спленоцитов животных в группе А был статистически выше, начиная с 7-го дня после 2-й иммунизации и до конца наблюдения, (р < 0,005 на 21-й и 28-й дни; р < 0,05 на 35-й день) относительно аналогичных показателей у животных в группе В. Статистически достоверная разница между ИС спленоцитов антигеном ЧИКВ у животных групп А и В во все сроки наблюдения после 2-й иммунизации свидетельствует не только о специфичности пролиферативной реакции спленоцитов у иммунных животных, но и о дозозависимом эффекте. Спленоциты неиммунных животных группы C отвечали выраженной пролиферацией на стимуляцию только митогенами Т- и В-клеток (конканавалином А и липополисахаридом), при этом ИС не менялся при стимуляции вирусными антигенами во все сроки наблюдения (рис. 1).
Рост продукции ИФН-γ спленоцитами животных при их стимуляции специфическим антигеном (табл. 2) свидетельствует о формировании специфического клеточного иммунного ответа у вакцинированных животных.
Таблица 2. Продукция ИФН-γ при стимуляции in vitro спленоцитов мышей линии C57Bl/6, иммунизированных препаратом с разным содержанием антигена ЧИКВ
Table 2. Production of IFN-γ in response to splenocytes in vitro stimulation of C57Bl/6 mice, immunized with the preparation contained different CHIKV antigen dose
Группа Group | Антиген Antigen | Концентрация ИФН-γ, пкг/мл | INF-γ concentration, pg/ml | ||||
0-е сутки (1-я иммунизация) 0 day (1st immunization) | 14-е сутки (2-я иммунизация) 14th day (2nd immunization) | 21-е сутки 21st day | 28-е сутки 28th day | 35-е сутки 35th day | ||
A | ЧИКВ | CHIKV | 5,0 ± 0,4 | 12,8 ± 1,3*+# | 49,0 ± 4,2*+# | 57,0 ± 5,7*+# | 47,0 ± 2,7*+# |
ВГА | VHB | 5,4 ± 0,9 | 4,8 ± 0,8 | 5,4 ± 0,9 | 5,0 ± 0,7 | 5,8 ± 0,4 | |
КонА | Conkanavalin A | 1066,0 ± 84,0 | 1110,0 ± 22,4 | 1269,0 ± 74,7 | 1093,0 ± 55,5 | 1125,0 ± 125,0 | |
ФСБ | PBS | 5,8 ± 0,4 | 5,4 ± 0,9 | 5,4 ± 0,9 | 5,0 ± 0,7 | 4,4 ± 0,5 | |
B | ЧИКВ | CHIKV | 4,4 ± 0,5 | 6,8 ± 0,8 | 19,6 ± 3,6*# | 16,0 ± 1,6*# | 13,6 ± 2,7*# |
ВГА | VHB | 5,0 ± 0,7 | 5,0 ± 0,7 | 5,4 ± 0,9 | 5,0 ± 0,7 | 5,4 ± 0,9 | |
КонА | Conkanavalin A | 1133,0 ± 90,9 | 1108,0 ± 36,8 | 1249,0 ± 57,3 | 1229,0 ± 27,0 | 1089,0 ± 73,7 | |
ФСБ | PBS | 5,9 ± 0,8 | 5,9 ± 0,8 | 5,0 ± 0,7 | 5,0 ± 0,7 | 4,4 ± 0,5 | |
C | ЧИКВ | CHIKV | 5,0 ± 0,7 | 5,0 ± 0,7 | 5,4 ± 0,9 | 4,8 ± 0,8 | 4,8 ± 0,8 |
ВГА | VHB | 5,0 ± 0,7 | 5,4 ± 0,9 | 4,8 ± 0,8 | 5,8 ± 0,4 | 5,4 ± 0,9 | |
КонА | Conkanavalin A | 1153,0 ± 29,5 | 1145,0 ± 94,2 | 1249,0 ± 35,8 | 1128,0 ± 56,6 | 1113,0 ± 46,6 | |
ФСБ | PBS | 5,0 ± 0,7 | 5,8 ± 0,4 | 5,4 ± 0,9 | 5,0 ± 0,7 | 5,8 ± 0,4 | |
Примечание. *р < 0,05 относительно исходных показателей на 0-е сутки; +р < 0,005 относительно группы В; #р < 0,05 относительно группы C. Забор крови для контроля специфического иммунитета на 0-е и 14-е сутки у животных проводили до вакцинации.
Note. *р < 0.05 in comparison with day 0; +р < 0.005 in comparison to those in group В; #р < 0.05 in comparison to those in group C. Animals were bled on days 0 and 14 for the specific immunity testing before antigen administration.
Продукция ИФН-γ спленоцитами животных группы А достоверно превосходила таковые значения в группе В во всех сроках наблюдения (p < 0,05–0,005). У животных группы А повышенная продукция ИФН-γ спленоцитами сохранялась до 35-х суток наблюдения. Продемонстрирован дозозависимый эффект продукции ИФН-γ спленоцитами иммунных животных.
Концентрация цитокинов в сыворотке крови мышей
Введение Al(OH)3 не приводило к достоверному увеличению концентрации ни одного из исследованных цитокинов в сыворотке крови мышей. Напротив, введение инактивированного антигена ЧИКВ приводило к увеличению концентрации исследуемых цитокинов как после 1-й, так и после 2-й вакцинации с максимальными подъёмами после 1-й иммунизации. Исключение составила продукция ИНФ-γ. К 35-му дню после 1-й иммунизации продукция всех исследуемых цитокинов вернулась к исходным значениям (рис. 2–4).
Рис. 2. Динамика уровня цитокинов ИЛ-6, ИЛ-10 и ИЛ-12 в сыворотке мышей линии C57Bl/6, иммунизированных инактивированным препаратом с разным содержанием антигена ЧИКВ. Здесь и на рис. 3, 4: стрелка — день иммунизации; забор крови для контроля специфического иммунитета на 0-е и 14-е сутки у животных проводился до вакцинации.
Fig. 2. Dynamic of cytokines IL-6, IL-10, IL-12 in C57Bl/6 mice’ sera immunized with the different doses of inactivated CHIKV. Here and on Figs. 3, 4: arrow — day of immunization; animals were bled on days 0 and 14 for the specific immunity testing before antigen administration.
Рис. 3. Динамика уровня цитокинов ФНО-α и ИЛ-1β в сыворотке мышей линии C57Bl/6, иммунизированных инактивированным препаратом с разным содержанием антигена ЧИКВ.
Fig. 3. Dynamic of cytokines TNF-α and IL-1β in C57Bl/6 mice’ sera immunized with the different doses of inactivated CHIKV.
Рис. 4. Динамика уровня цитокинов ИЛ-2, ИЛ-4 и ИФН-γ в сыворотке мышей линии C57Bl/6, иммунизированных инактивированным препаратом с разным содержанием антигена ЧИКВ.
Fig. 4. Dynamic of cytokines IL-2, IL-4 and IFN-γ in C57Bl/6 mice’ sera immunized with the different doses of inactivated CHIKV.
Максимальный подъем концентрации ИЛ-6, ИЛ-10 и ИЛ-12 в сыворотке крови мышей отмечался в 1-е сутки после 1-й иммунизации (рис. 2). Концентрация ИЛ-10 увеличилась практически в 4 раза относительно исходного уровня (р < 0,0001), т.е. в большей степени, чем концентрации ИЛ-6 и ИЛ-12, которые выросли почти в 2 раза (р < 0,001). Концентрация ИЛ-10, ИЛ-12 и ИЛ-6 у животных группы А, вакцинированных дозой 40 мкг, достоверно превосходила показатели у животных группы В, вакцинированных дозой 10 мкг, как после 1-й, так и после 2-й иммунизации (р < 0,001 для ИЛ-10, ИЛ-12 и р < 0,005 для ИЛ-6).
Максимальный подъём концентрации ИЛ-1β и ФНО-α в сыворотке крови мышей выявлен на 3-и сутки после 1-й иммунизации; р < 0,001 относительно исходного уровня (рис. 3). При этом концентрация ИЛ-1β и ФНО-α у животных группы А, вакцинированных дозой 40 мкг, достоверно превосходила показатели у животных группы В, вакцинированных дозой 10 мкг после 1-й (р < 0,001) и 2-й иммунизации (р < 0,005).
Максимальный подъём концентрации ИЛ-2 и ИЛ-4 отмечался на 7-й день после 1-й иммунизации (рис. 4). В группе А ИЛ-4 продемонстрировал практически 4-кратный прирост (р < 0,0001). Концентрации ИЛ-4 и ИЛ-2 у животных группы А, вакцинированных дозой 40 мкг, достоверно превосходили показатели у животных группы В, вакцинированных дозой 10 мкг, как после 1-й, так и после 2-й иммунизации (р < 0,001).
Следует отметить отличную от всех остальных цитокинов динамику ИФН-γ в обеих группах иммунизированных животных. Наблюдался очень умеренный подъём уровня ИФН-γ (р < 0,05) после 1-й иммунизации на 3–7-й дни и выраженный подъём (в 5 раз) после 2-й иммунизации (р < 0,0001) в группе А. В группе В подъёма ИФН-γ после 1-й иммунизации практически не наблюдалось, а после 2-й иммунизации подъём был статистически достоверен (р < 0,01).
Максимальная концентрация ИФН-γ у животных группы А, вакцинированных дозой 40 мкг, достоверно превосходила таковую у животных группы В, вакцинированных дозой 10 мкг, после 2-й иммунизации (р < 0,0001). Динамика продукции ИФН-γ в спленоцитах животных, описанная выше, также демонстрировала более значительный подъём уровня ИФН-γ после 2-й иммунизации животных в обеих группах.
Результаты оценки протективности кандидатной вакцины представлены в табл. 3. Следует отметить, что введение 0,9% раствора NaCl в стопу животного не сопровождалось нарастанием отёка. По результатам измерений стопы рассчитывали индекс отёка, который статистически достоверно различался между вакцинированными и невакцинированными животными; животные группы А имели статистически меньший индекс отёка относительно такового у животных группы В.
Таблица 3. Результаты оценки индекса отёка стопы и биологический титр ЧИКВ в сыворотке крови у мышей, дважды иммунизированных инактивированным препаратом с разным содержанием антигена ЧИКВ, после введения ЧИКВ в дозе 2,89 ± 0,10 lg ТЦД50/мл в дорсальную поверхность стопы
Table 3. Feet swelling indices and CHIKV titres’ in the mice’ sera twice immunized with the different doses of inactivated CHIKV antigen measured after the CHIKV injection in a dose of 2,89 ± 0,10 lg ТCID50/ml into the dorsal part of foot
Группа Group | Индекс отёка | Swelling index | Титр ЧИКВ, lg ТЦД50/мл | CHIKV titer, lg ТCID50/ml | |
6-е сутки | 6th day | 3-и сутки | 3th day | 6-е сутки | 6th day | |
А | 1,2 ± 0,21+# | Н.о. | N.d. | Н.о. | N.d. |
В | 2,1 ± 0,24 | 1,4 ± 0,13# | Н.о. | N.d. |
С | 3,04 ± 0,21+ | 4,3 ± 0,18 | 1,8 ± 0,18 |
Примечание. +р < 0,05 относительно группы В; #р < 0,005 относительно группы C. Н.о. — не определялся (ниже порога чувствительности метода).
Note. +р < 0.05 in comparison with group В; #р < 0.005 in comparison with group C. N.d. — not detectable (lower threshold).
Вирусемия наблюдалась в обеих точках наблюдения только в группе неиммунных животных группы С. В противоположность, в группе животных А, привитых максимальной дозой антигена ЧИКВ, вирусемия не определялась.
Обсуждение
Пожизненный иммунитет и практическое отсутствие повторных случаев инфицирования, перекрёстная защита между разными штаммами ЧИКВ [2, 4–6] и отсутствие специфической терапии инфекции делают вакцинацию наиболее перспективным путём профилактики лихорадки Чикунгунья.
Признавая острую необходимость в эффективной вакцине и учитывая её отсутствие на рынке, Всемирная организация здравоохранения оказывает поддержку странам в проведении эпиднадзора и борьбы с арбовирусами, в том числе с ЧИКВ5. С целью разработки эффективной вакцины используются различные стратегии и технологические платформы [4, 7]. Следует отметить, что безопасность инактивированных вакцин достижима исключительно за счёт затрат на организацию производства, соблюдения необходимых условий биобезопасности, а также постоянного контроля за полнотой инактивации вируса. Тем не менее такие преимущества инактивированных вакцин, как отсутствие риска реверсии вирулентности вакцинного штамма, а также стабильность самого препарата, что значительно упрощает и делает дешевле хранение и транспортировку, объясняет широкое использование технологической платформы для разработки вакцин. В настоящем исследовании продемонстрированы иммуногенные свойства инактивированного бета-пропиолактоном препарата для профилактики лихорадки Чикунгунья после двукратного введения мышам линии C57Bl/6. Иммуногенность кандидатного препарата подтверждена формированием специфического гуморального и клеточного иммунитета у лабораторных животных, а также сбалансированным ответом Т-хелперных клонов. Результаты, полученные нами в данном исследовании, сопоставимы с ранее описанными M. Tiwari и соавт. [8]. Максимальный прирост специфических АТ в реакции ИФА и РН, так же как и ИС спленоцитов in vitro, отмечен у животных, привитых обеими дозами препарата после двукратной иммунизации. Однако высокие титры специфических АТ и ИС спленоцитов сохранялись до конца срока наблюдения только в группе животных, привитых препаратом, содержащим 40 мкг антигена ЧИКВ. Дозозависимый эффект препарата был отмечен как при анализе титров специфических АТ и ИС спленоцитов in vitro, так и при анализе концентраций цитокинов в сыворотке мышей. Продукция всех исследованных цитокинов как в сыворотке мышей, так и при стимуляции спленоцитов животных in vitro была максимальной в группе животных, привитых препаратом, содержащим 40 мкг антигена ЧИКВ. Исследования продукции цитокинов после введения инактивированного препарата для профилактики лихорадки Чикунгунья в открытых научных источниках, по нашим данным, отсутствуют. Однако крайне важно при проведении исследований убедиться, что формирующийся поствакцинальный иммунитет будет достаточно сбалансированным между Т-хелперными клонами, т.к. нормальное функционирование иммунной системы строится на балансе Th1 и Th2, основанном на продукции ими регуляторных цитокинов. Несбалансированность активации Т-хелперных клонов может приводить к развитию иммунопатологических состояний, которые в случае препарата, содержащего антиген ЧИКВ, имеет особое значение.
Из провоспалительных цитокинов первым прореагировал на введение вакцины — ИЛ-6. ФНО-α и ИЛ-1β продемонстрировали умеренный подъём на 3-и сутки, а максимальный подъём ИЛ-2 был зарегистрирован на 7-е сутки после введения препарата. Выброс провоспалительных цитокинов уравновешивался значительным подъёмом противовоспалительных ИЛ-10 и ИЛ-4. Как известно, ИЛ-10 играет роль не только в контроле воспалительных реакций и ограничении чрезмерной реакции иммунитета, и появление его в первые дни также свидетельствует о стимуляции продукции ЧИКВ-специфических АТ [24, 25]. Были проведены интересные исследования роли ИЛ-10 на введение Al(OH)3 ИЛ-10-дефицитным мышам. Экспериментально было выявлено, что отсутствие передачи сигналов ИЛ-10 не ставило под угрозу индуцированную Al(OH)3 клеточную инфильтрацию в месте инъекции, но приводило к усилению антиген-специфического Th1-ответа после введения. Al(OH)3 усиливал транскрипцию и секрецию ИЛ-10 макрофагами и дендритными клетками. В целом эти результаты показали, что инъекция Al(OH)3 способствует выработке ИЛ-10, который может блокировать ответы Th1-иммунного ответа [25]. ИЛ-4 также служит маркером активации Th2-субпопуляции лимфоцитов. В нашем исследовании, наряду с ИЛ-10, отмечен значительный рост ИЛ-4 на 7-е сутки после вакцинации. Достаточно выраженный Th-2-клеточный иммунный ответ в нашем эксперименте можно объяснить не только эффективностью самого инактивированного антигена ЧИКВ, но и присутствием в препарате адъюванта — Al(OH)3. До недавнего времени было известно, что адъюванты на основе Al(OH)3 предпочтительно стимулируют Th2-клеточный иммунный ответ. Неоднократно продемонстрировано, что соли алюминия индуцируют Th2-клеточный ответ именно у мышей [8, 25]. Соли алюминия являются наиболее широко используемыми адъювантами почти столетие. Изначально считалось, что алюминий обеспечивает эффект депо, благодаря которому антиген медленно высвобождается с поверхности микрочастиц в месте введения, что позволяет антигенпрезентирующим клеткам постепенно использовать антиген. В последние годы было показано, что механизм действия солей алюминия в качестве адъюванта у человека не такой однозначный и является гораздо более сложным, чем предполагалось изначально. Факторы, оказывающие сильное влияние на реакцию иммунитета, вызываемую применением Al(OH)3, включают скорость адсорбции, силу адсорбции, размер и однородность частиц Al(OH)3, дозировку адъюванта и природу используемых антигенов [26, 27]. Текущее понимание механизма действия адъювантов на основе Al(OH)3 включает, кроме эффекта репозитория, профагоцитарный эффект и активацию провоспалительного пути NLRP3. Всё это в совокупности стимулирует как врождённый, так и приобретённый иммунитет, а также активирует систему комплемента [26]. Продемонстрирована секреция ИЛ-1β и ИЛ-6 in vitro, которая значительно повышалась под действием Al(OH)3 в моноцитах человека [28]. Соли алюминия индуцируют продукцию мочевой кислоты in vivo, что является необходимым фактором для инфильтрации воспалительных клеток [29]. В свою очередь повышенный уровень мочевой кислоты приводит к активации NLRP3 инфламмасомы и, таким образом, секреции ИЛ-1β [29]. Более того, были идентифицированы два новых иммунологически значимых клеточных пути стимуляции моноцитов Al(OH)3: первый — секреция ИФН I типа, потенциально индуцируемая TLR и/или NOD-подобной передачей сигналов; второй — представление антигенов HLA классов I и II, индуцированное ИФН-γ [30]. О функциональном состоянии Th1-субпопуляции принято судить по продукции иммунокомпетентными клетками ИФН-γ. Формирование специфического клеточного иммунитета у мышей после двукратного введения инактивированного антигена ЧИКВ в дозе 40 мкг в нашем исследовании подтверждается данными ИС спленоцитов животных in vitro, что соответствует опубликованным данным [8, 11]. Пятикратный подъем концентрации ИФН-γ в сыворотке крови мышей после 2-й вакцинации также свидетельствует о стимуляции специфического клеточного иммунитета. За мощным выбросом ИЛ-10 в 1-е сутки после введения препарата мышам следовал рост продукции не только ИФН-γ, но и ФНО-α и ИЛ-2, которые также являются медиаторами Th1-клеточного ответа. Можно утверждать, что в нашем эксперименте путь введения и соотношение дозы антигена и Al(OH)3 и, что более вероятно, именно сочетание антигена ЧИКВ и Al(OH)3, привели к сбалансированному ответу про- и противовоспалительных цитокинов, а также стимуляции как гуморального, так и клеточного иммунитета.
Нами была использована нелетальная модель ЧИКВ-инфекции на мышах линии C57Bl/6, ранее не использованная отечественными разработчиками аналогичных препаратов, для исследования протективности инактивированного препарата. С помощью этой модели была продемонстрирована специфичность отёка лапы и транзиторная вирусемия у неиммунных животных. У вакцинированных животных отёчность лапы была статистически менее значима, а вирусемия была зарегистрирована однократно только в группе животных, вакцинированных минимальной дозой. Данная нелетальная модель инфекции ЧИКВ у мышей позволила подтвердить эффективность разработанной кандидатной вакцины против ЧИКВ, которую можно объяснить в том числе балансом между Т-хелперными клонами, Th1 и Th2, что было подтверждено концентрациями регуляторных цитокинов в сыворотке иммуннизированных животных.
Результаты представленного исследования иммуногенности препарата, содержащего инактивированный ЧИКВ, а также результаты исследования протективности данного препарата позволяют оценить его как перспективный для дальнейших исследований. Доза препарата 40 мкг/0,5 мл и двукратная схема иммунизации также может быть оценена как адекватная. Выбранная нами технологическая платформа позволяет достаточно быстро произвести вакцину для профилактики лихорадки Чикунгунья на линии клеток 4647.
Заключение
Двукратное введение мышам линии C57Bl/6 вируса ЧИКВ (инактивированного бета-пропиолактоном и очищенного, 40 мкг/0,5 мл) обеспечивало развитие специфического Th1/Th2-иммунного ответа — гуморального (АТ, обладающие вируснейтрализующим действием), клеточного (выраженная пролиферация спленоцитов in vitro и продукция ИФН-γ), а также сбалансированной продукцией про- и противовоспалительных цитокинов. Исследование протективности в нелетальной модели животных подтвердило эффективность инактивированного препарата. Полученные результаты позволяют оценить препарат как перспективный для профилактики лихорадки Чикунгунья.
1 Code of Federal Regulations. Title 21. Section 601.91. Approval based on evidence of effectiveness from studies in animals. Washington: FDA; 2020.
2 FDA approves first vaccine to prevent disease caused by Chikungunya virus. U.S. Food and Drug Administration. Published November 9, 2023. Accessed November 12, 2023. URL: https://www.fda.gov/news-events/press-announcements/fda-approves-first-vaccine-prevent -disease-caused-chikungunya-virus
3 Phase-I open label, dose-escalation clinical trial to evaluate the safety, tolerability and immunogenicity of chikungunya vaccine in healthy adults of 18 to 50 years age. 2017. Clinical Trials Registry—India, CTRI, Hyderabad.
URL: https://clinicaltrials.gov/study/NCT04603131
4 Ф.С.3.3.1.0029.15. Вакцина для профилактики гепатита A культуральная, очищенная концентрированная адсорбированная инактивированная жидкая. Государственная фармакопея Российской Федерации. М.; 2018. Т. 4.
5 Chikungunya. URL: https://www.who.int/news-room/fact-sheets/detail/chikungunya
Об авторах
Елена Викторовна Отрашевская
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: e.v.otrashevskaja@mail.ru
ORCID iD: 0000-0002-2491-4072
в.н.с. лаб. молекулярной биотехнологии
Россия, МоскваКонстантин Владимирович Каа
Федеральный научный центр исследования и разработки иммунобиологических препаратов имени М.П. Чумакова
Email: e.v.otrashevskaja@mail.ru
ORCID iD: 0000-0002-8446-1853
н.с. лаб. молекулярной биологии вирусов
Россия, МоскваАлексей Сергеевич Оксанич
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: e.v.otrashevskaja@mail.ru
ORCID iD: 0000-0002-8600-7347
к.б.н., в.н.с. лаб. молекулярной биотехнологии
Россия, МоскваНикита Валентинович Мурашко
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: e.v.otrashevskaja@mail.ru
ORCID iD: 0009-0002-9161-064X
м.н.с. лаб. молекулярной биотехнологии
Россия, МоскваАлександр Григорьевич Куслий
«Вектор-Биальгам»
Автор, ответственный за переписку.
Email: e.v.otrashevskaja@mail.ru
ORCID iD: 0000-0002-0732-9314
к.м.н., директор по качеству
Россия, КольцовоАнатолий Геннадиевич Красько
Республиканский научно-практический центр эпидемиологии и микробиологии
Email: e.v.otrashevskaja@mail.ru
ORCID iD: 0000-0002-2765-3525
к.м.н., в.н.с. Республиканской коллекции патогенных биологических агентов
Белоруссия, МинскВиталий Васильевич Зверев
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: e.v.otrashevskaja@mail.ru
ORCID iD: 0000-0001-5808-2246
д.м.н., профессор академик РАН, научный руководитель
Россия, МоскваГеоргий Михайлович Игнатьев
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: e.v.otrashevskaja@mail.ru
ORCID iD: 0000-0002-9731-3681
д.м.н., профессор, г.н.с. лаб. молекулярной биотехнологии
Россия, МоскваСписок литературы
- Weaver S.C., Lecuit M. Chikungunya virus and the global spread of a mosquito-borne disease. N. Engl. J. Med. 2015;372(13):1231–9. doi: https://doi.org/10.1056/nejmra1406035
- Deeba D., Islam A., Kazim S. N., et al. Chikungunya virus: Recent advances in epidemiology, host pathogen interaction & vaccine strategies. Pathog. Dis. 2016;74(3):ftv119. doi: https://doi.org/10.1093/femspd/ftv119
- Staples J.E., Breiman R.F., Powers A.M. Chikungunya fever: an epidemiological review of a re-emerging infectious disease. Clin. Infect. Dis. 2009;49(6):942–8. doi: https://doi.org/10.1086/605496
- Отрашевская Е.В., Трухин В.П., Меркулов В.А., Игнатьев Г.М. Прогресс в разработке вакцин для профилактики лихорадки Чикунгунья и перспективы появления на рынке. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(1):42–64. Otrashevskaya E.V., Trukhin V.P., Merkulov V.A., Ignat'ev G.M. Chikungunya vaccines: advances in the development and prospects for marketing approval. Biological Products. Prevention, Diagnosis, Treatment. 2023;23(1):42–64. doi: https://doi.org/10.30895/2221-996X-2023-23-1-42-64 EDN: https://elibrary.ru/uoykrm
- Galatas B., Ly S., Duong V., et al. Long-lasting immune protection and other epidemiological findings after Chikungunya emergence in a Cambodian Rural Community, April (2012). PLoS Negl. Trop. Dis. 2016;10(1):e0004281. doi: https://doi.org/10.1371/journal.pntd.0004281
- Pierro A., Rossini G., Gaibani P., et al. Persistence of anti-chikungunya virus-specific antibodies in a cohort of patients followed from the acute phase of infection after the 2007 outbreak in Italy. New Microbes New Infect. 2015;7:23–5. doi: https://doi.org/10.1016/j.nmni.2015.04.002
- Reyes-Sandoval A. 51 years in of Chikungunya clinical vaccine development: A historical perspective. Hum. Vaccin. Immunother. 2019;15(10):2351–8. doi: https://doi.org/10.1080/21645515.2019.1574149
- Tiwari M., Parida M., Santhosh S.R., et al. Assessment of immunogenic potential of Vero adapted formalin inactivated vaccine derived from novel ECSA genotype of Chikungunya virus. Vaccine. 2009;27(18):2513–22. doi: https://doi.org/10.1016/j.vaccine.2009.02.062
- Kumar M., Sudeep A.B., Arankalle V.A. Evaluation of recombinant E2 protein-based and whole-virus inactivated candidate vaccines against Chikungunya virus. Vaccine. 2012;30(43): 6142–9. DOI: https://doi.org/10.1016/j.vaccine.2012.07.072
- Rudd P.A., Raphael A.P., Yamada M., et al. Effective cutaneous vaccination using an inactivated Chikungunya virus vaccine delivered by Foroderm. Vaccine. 2015;33(39):5172–80. doi: https://doi.org/10.1016/j.vaccine.2015.07.099
- Игнатьев Г.М., Каа К.В., Антонова Л.П. и др. Иммуногенные свойства препарата, содержащего инактивированный β-пропиолактоном антиген вируса Чикунгунья. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(5):519–27. Ignatyev G.M., Atrasheuskaya A.V., Antonova L.P., et al. Immunogenic properties of the preparation containing the Chikungunya virus antigen inactivated by β-propiolactone. Journal of Microbiology, Epidemiology and Immunobiology. 2021;98(5):519–27. DOI: https://doi.org/10.36233/0372-9311-159 EDN: https://elibrary.ru/kezrsh
- Миронова Л.Л., Конюшко О.И., Попова В.Д., Грачев В.П. К вопросу об использовании различных различных видов культур клеток в производстве противовирусных препаратов. Успехи современного естествознания. 2011;(12):43–5. Mironova L.L., Konushko O.I., Popova V.D., Grachev V.P. To the question about using various different types of cell cultures in the antiviral preparations’ production. Advances in Current Natural Sciences. 2011;(12):43–5. EDN: https://elibrary.ru/oiplor
- Радаева И.Ф., Думченко Н.Б., Нечаева Е.А. Культивирование клеток на микроносителях в биореакторах. Вестник ПНИПУ. Химическая технология и биотехнология. 2019;(2):22–32. Radaeva I.F., Dumchenko N.B., Nechaeva E.A. The cultivation of cells on microcarriers in bioreactors. PNRPU Bulletin. Chemical Technology and Biotechnology. 2019;(2):22–32. DOI: https://doi.org/10.15593/2224-9400/2019.2.02 EDN: https://elibrary.ru/vkxbiy
- Каа К.В., Игнатьев Г.М., Синюгина А.А., Ишмухаметов А.А. Чувствительность клеточных линий к вирусу Чикунгунья и подбор метода наработки вирусного материала в промышленных объемах. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(1):111–20. Kaa K.V., Ignatyev G.M., Sinyugina A.A., Ishmukhametov A.A. Susceptibility of various cell lines to the Chikungunya virus and method selection for commercial-scale production of viral material. Biological Products. Prevention, Diagnosis, Treatment. 2023;23(1):111–20. doi: https://doi.org/10.30895/2221-996X-2023-23-1-111-120 EDN: https://elibrary.ru/kcmppz
- Gardner J., Anraku I., Le T.T., et al. Chikungunya virus arthritis in adult wild-type mice. J. Virol. 2010;84(16):8021–32. doi: https://doi.org/10.1128/jvi.02603-09
- Morrison T.E., Oko L., Montgomery S.A., et al. A mouse model of chikungunya virus-induced musculoskeletal inflammatory disease: evidence of arthritis, tenosynovitis, myositis, and persistence. Am. J. Pathol. 2011;178(1):32–40. doi: https://doi.org/10.1016/j.ajpath.2010.11.018
- Hallengärd D., Kakoulidou M., Lulla A., et al. Novel attenuated Chikungunya vaccine candidates elicit protective immunity in C57Bl/6 mice. J. Virol. 2014;88(5):2858–66. doi: https://doi.org/10.1128/jvi.03453-13
- Arevalo M.T., Huang Y., Jones C.A., Ross T.M. Vaccination with a chikungunya virus-like particle vaccine exacerbates disease in aged mice. PLoS Negl. Trop. Dis. 2019;13(4):e0007316. doi: https://doi.org/10.1371/journal.pntd.0007316
- Slifka D.K., Raue H.P., Weber W.C., et al. Development of a next-generation chikungunya virus vaccine based on the HydroVax platform. PLoS Pathog. 2022;18(7):e1010695. doi: https://doi.org/10.1371/journal.ppat.1010695
- Broeckel R.M., Haese N., Ando T., et al. Vaccine-induced skewing of T cell responses protects against Chikungunya virus disease. Front. Immunol. 2019;10:2563. doi: https://doi.org/10.3389/fimmu.2019.02563
- Игнатьев Г.М., Каа К.В., Оксанич А.С. и др. Индикация и идентификация вирусов денге и Чикунгунья в комарах рода Aedes spp., отловленных в Центральной Америке. Журнал микробиологии, эпидемиологии и иммунобиологии. 2020; 97(3):227–32. Ignatyev G.M., Kaa K.V., Oksanich A.S., et al. Indication and identification of Dengue and Chikungunya viru- ses in Aedes spp. mosquitoes captured in Central America. Journal of Microbiology, Epidemiology and Immunobiology. 2020;97(3): 227–32. DOI: https://doi.org/10.36233/0372-9311-2020-97-3-4 EDN: https://elibrary.ru/ufhtab
- Mayer U.B., Haller C., Haidinger W., et al. Bacterial ghosts as an oral vaccine: a single dose of Escherichia coli O157:H7 bacterial ghosts protects mice against lethal challenge. Infect. Immun. 2005;73(8):4810–7. doi: https://doi.org/10.1128/iai.73.8.4810-4817.2005
- Ашмарин И.П., Воробьев А.А. Статистические методы в микробиологических исследованиях. Ленинград;1962. Ashmarin I.P., Vorobyov A.A. Statistical Methods in Microbiological Research. Leningrad;1962.
- Rojas J.M., Avia M., Martín V., Sevilla N. IL-10: A multifunctional cytokine in viral infections. J. Immunol. Res. 2017;2017:6104054. DOI: https://doi.org/10.1155/2017/6104054
- Oleszycka E., McCluskey S., Sharp F.A., et al. The vaccine adjuvant alum promotes IL-10 production that suppresses Th1 responses. Eur. J. Immunol. 2018;48(4):705–15. doi: https://doi.org/10.1002/eji.201747150
- He P., Zou Y., Hu Z. Advances in aluminum hydroxide-based adjuvant research and its mechanism. Hum. Vaccin. Immunother. 2015;11(2):477–88. doi: https://doi.org/10.1080/21645515.2014.1004026
- Badran G., Angrand L., Masson J.D., et al. Physico-chemical properties of aluminum adjuvants in vaccines: Implications for toxicological evaluation. Vaccine. 2022;40(33):4881–8. doi: https://doi.org/10.1016/j.vaccine.2022.06.064
- Vrieling H., Kooijman S., de Ridder J.W., et al. Activation of human monocytes by colloidal aluminum salts. J. Pharm. Sci. 2020; 109(1):750–60. DOI: https://doi.org/10.1016/j.xphs.2019.08.014
- Eisenbarth S.C., Colegio O.R., O’Connor W., et al. Crucial role for the Nalp3 inflammasome in the immunostimulatory properties of aluminum adjuvants. Nature. 2008;453(7198):1122–6. doi: https://doi.org/10.1038/nature06939
- Kooijman S., Brummelman J., van Els C.A.C.M., et al. Novel identified aluminum hydroxide-induced pathways prove monocyte activation and pro-inflammatory preparedness. J. Proteomics. 2018;175:144–55. doi: https://doi.org/10.1016/j.jprot.2017.12.021
Дополнительные файлы