Живые аттенуированные вакцины против COVID-19: подходы к разработке и перспективы клинического применения
- Авторы: Корчевая Е.Р.1, Грачева А.В.1, Дьяков И.Н.1, Зверев В.В.1, Файзулоев Е.Б.1,2
-
Учреждения:
- Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
- Российская медицинская академия непрерывного профессионального образования
- Выпуск: Том 100, № 3 (2023)
- Страницы: 225-236
- Раздел: ОБЗОРЫ
- URL: https://microbiol.crie.ru/jour/article/view/15838
- DOI: https://doi.org/10.36233/0372-9311-404
- EDN: https://elibrary.ru/psdxzr
- ID: 15838
Цитировать
Аннотация
Несмотря на объявленное ВОЗ завершение пандемии, COVID-19 остаётся актуальной проблемой здравоохранения во всём мире. Современные вакцины зачастую формируют либо только гуморальный, либо только клеточный иммунитет. Кроме того, появление и распространение новых эпидемиологически значимых вариантов SARS-CoV-2 значительно снижает эффективность вакцинопрофилактики. Всё это требует совершенствования существующих вакцин против COVID-19. Одним из возможных подходов к решению данной проблемы является создание «универсальной» вакцины, обладающей перекрёстной протективной активностью в отношении разных антигенных вариантов вируса. В связи с этим представляет интерес разработка живой аттенуированной вакцины, способной активировать не только гуморальное, но и клеточное звено иммунитета, обеспечивая продолжительный иммунный ответ и перекрёстную защиту от разных вариантов вируса.
В данном обзоре рассматриваются реализованные подходы к получению аттенуированных штаммов SARS-CoV-2 и оценивается потенциал их клинического применения. Одни авторы для аттенуации вируса используют методы генной инженерии и обратной генетики, такие как сайт-направленный мутагенез и деоптимизация кодонов. Другие используют традиционный подход, направленный на получение мутантов вируса путём длительного пассирования в культуре клеток в селективных условиях. Накопленный на сегодняшний день опыт показывает большой потенциал создания высокоэффективной живой аттенуированной вакцины против COVID-19.
Ключевые слова
Полный текст
Введение
Несмотря на объявленное ВОЗ завершение пандемии, COVID-19 остается актуальной глобальной проблемой здравоохранения. Для снижения бремени этого заболевания предпринимаются беспрецедентные по масштабу усилия, включающие массовую вакцинопрофилактику, разработку новых и «перенацеливание» существующих лекарственных препаратов. Для специфической профилактики COVID-19 в мире разработаны и применяются вакцины на основе вирусных векторов, мРНК, субъединичные вакцины на основе вирусных рекомбинантных белков, а также инактивированные цельновирионные вакцины [1–5]. Использование этих технологических платформ позволяет в короткие сроки разрабатывать вакцины с хорошим профилем безопасности, обеспечить профилактику тяжёлого течения COVID-19 или летального исхода, вызванного гомологичным вариантом вируса (т.е. вариантом вируса, на основе которого разработана вакцина). Появление и широкое распространение новых эпидемиологически значимых вариантов SARS-CoV-2, в особенности варианта Omicron и его сублиний, ускользающих от иммунной защиты, сформированной против «уханьского» штамма, на основе которого создано большинство зарегистрированных вакцин, значительно снизило эффективность вакцинопрофилактики [6–8]. Таким образом, в настоящее время для поддержания эффективности вакцинации на высоком уровне целесообразно совершенствование существующих вакцин в соответствии с актуальным набором циркулирующих вариантов SARS-CoV-2. Одним из возможных подходов к решению данной проблемы является создание «универсальной» вакцины, обладающей перекрёстной протективной активностью в отношении разных антигенных вариантов вируса. В частности, представляет интерес разработка живой аттенуированной вакцины (ЖАВ), способной активировать не только гуморальное, но и клеточное звено иммунитета, обеспечивая продолжительный иммунный ответ и перекрестную защиту от разных вариантов вируса [9, 10]. Нужно отметить, что в настоящее время потенциал ЖАВ в профилактике COVID-19 остается практически нереализованным.
Зарегистрированные в настоящее время ЖАВ высокоэффективны и успешно применяются для специфической профилактики таких заболеваний, как полиомиелит, корь, краснуха, ветряная оспа, эпидемический паротит, грипп [11]. Эти вакцины разрабатывались путём получения мутантных форм вируса, имеющих сниженную способность к репродукции в культуре клеток человека [12, 13], либо получением холодоадаптированных (ca, cold-adapted) температурочувствительных (ts, temperature sensitive) вариантов, не способных к размножению при физиологической температуре тела человека [14].
Цель настоящего обзора — рассмотреть реализованные подходы к аттенуации SARS-CoV-2 и оценить потенциал клинического применения ЖАВ против COVID-19.
Подходы к аттенуации SARS-CoV-2
В отношении получения аттенуированных штаммов SARS-CoV-2 к настоящему моменту накоплен определённый опыт. Одни авторы для аттенуации вируса используют методы генной инженерии и обратной генетики, такие как сайт-направленный мутагенез и деоптимизация кодонов [15–20]. Другие применяют традиционный подход, направленный на получение мутантов вируса путём длительного пассирования в культуре клеток в селективных условиях [21–24]. Клинические испытания в настоящее время проходит единственная ЖАВ против COVID-19 — вакцина CoviLiv (ранее COVI-VAC; разработчики: «Codagenix» (США) и Институт сыворотки (Индия)), представляющая собой вирус с деоптимизированными кодонами в гене S-белка [5].
Классические (традиционные) подходы к аттенуации SARS-CoV-2
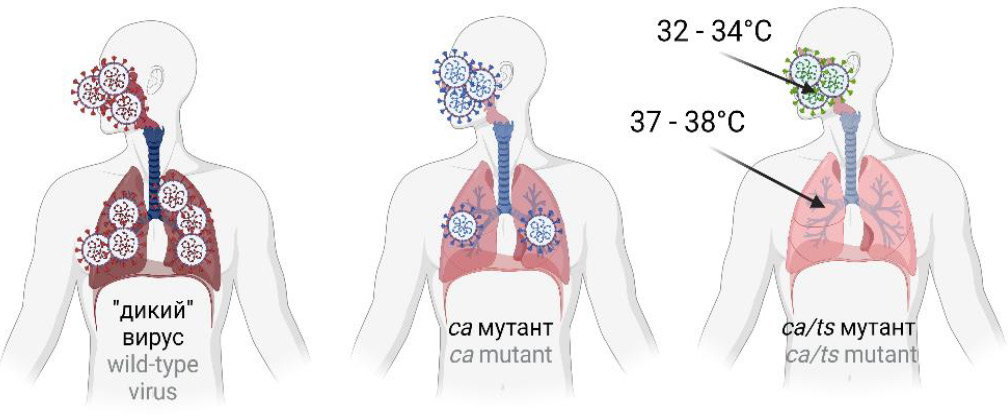
Одним из классических подходов к аттенуации вирусов является их адаптация к выращиванию при пониженной температуре, проводимая, как правило, в клетках другого хозяина. Так были созданы живые вакцины против гриппа, краснухи, кори [25–29], которые нашли широкое применение в разных странах мира. Холодовая адаптация — это процесс, при котором вирус постепенно приспосабливается к росту в культуре клеток при пониженной температуре, что может сопровождаться снижением репродуктивной активности при температуре 37ºC или выше. Адаптация вируса к новому хозяину и росту при пониженной температуре приводит к появлению мутантных форм вируса, отличающихся пониженной репродуктивной активностью в организме человека. В частности, вирус, обладающий ca- и ts-фенотипами, не способен эффективно размножаться и вызывать патологические изменения в организме человека, где температура превышает 37ºC (рис. 1). Сa-фенотип — это способность вируса эффективно размножаться в культуре клеток при пониженной температуре в отличие от родительского штамма. Ts-фенотип характеризуется неспособностью вируса размножаться при температуре 37ºC, 39ºC или 41ºC, тогда как родительский штамм в этих условиях размножается.
Рис. 1. Вирулентность «дикого», холодоадаптированного (са) и температурочувствительного (са/ts) штаммов респираторного вируса. «Дикий» штамм способен поражать верхние и нижние отделы дыхательных путей, вызывая пневмонию, в то время как ca-штамм поражает преимущественно верхние отделы, а ca/ts — только верхние. / Fig. 1. Virulence of the wild-type, cold-adapted (ca) and temperature-sensitive (ca/ts) strains of the respiratory virus. The wild-type strain can affect the upper and lower respiratory tract, causing pneumonia, while the ca-strain primarily affects the upper compartments, and ca/ts affects only the upper compartments of the respiratory tract.
В качестве примера можно привести уже реализованный аналог вакцины против респираторного вируса — живую гриппозную вакцину (ЖГВ), которая вводится интраназально. ЖГВ индуцирует формирование не только системного гуморального и клеточного иммунитета, но и местного мукозального иммунитета в месте проникновения вируса в организм («входных воротах» инфекции) — слизистой оболочке дыхательных путей. В основе ЖГВ лежит использование ca-штамма — «донора» аттенуации, имеющего во «внутренних генах» мутации, которые определяют ts-фенотип вируса (способен размножаться при температуре 25–33ºC, но не при 37–39ºC) [30]. «Внутренние гены» кодируют все белки вируса гриппа за исключением поверхностных антигенов — гемагглютинина и нейраминидазы. Таким образом, ca/ts-штаммы вируса гриппа при интраназальном введении поражают верхние отделы дыхательных путей (это определяет их иммуногенность), но не способны размножаться в лёгких и вызывать пневмонию. Вакцинные штаммы для ЖГВ получают путём реассортации донорского штамма с актуальными штаммами, в результате которой штаммы-реассортанты несут «внутренние гены», определяющие их аттенуационный (att) фенотип, и гены гемагглютинина и нейраминидазы, ответственные за протективные свойства вируса [29–31]. Опираясь на существующий опыт разработки ЖГВ, несколько научных групп разрабатывают ЖАВ против COVID-19.
Для аттенуации SARS-CoV-2 в ряде работ вирус адаптировали к росту при пониженной температуре с одновременной сменой хозяина [21, 22, 24, 32], тогда как в работе X.F. Li и соавт. аттенуация достигнута только путём смены хозяина [13]. Изоляцию и дальнейшее культивирование вируса проводили в культуре клеток почки обезьяны (линии Vero CCL-81 либо Vero E6). Для получения ca-штаммов пассировали дикий (родительский) штамм при постепенно понижаемой до 21–23ºC температуре. При достижении желаемой температуры проводили ещё нескольких пассажей са-вируса при пониженной температуре для закрепления фенотипа и клонировали методом бляшек [24] либо методом предельных разведений [21, 32]. У выбранных случайным образом сa-клонов, полученных на предыдущем этапе, определяли наличие ts-фенотипа [21, 24, 33], т.к. он, наряду с сa-фенотипом, является вероятным маркером аттенуации вируса [14].
Впервые получение аттенуированного са-вируса SARS-CoV-2 описали S.H. Seo и соавт. [21]. Клинический изолят SARS-CoV-2 аттенуировали путём холодовой адаптации до температуры 22ºC, проводя каждый пассаж при всё более низкой температуре при условии проявления выраженного цитопатического действия. Полученный аттенуированный штамм отличался наличием как ca-, так и ts-фенотипов, что было сопряжено с появлением 59 мутаций в генах структурных и неструктурных белков, включая 37 несинонимичных замен. Иммунизированные этим аттенуированным вирусом трансгенные мыши линии K18-hACE2, несущие ген человеческого ACE2-рецептора, после экспериментального заражения диким типом SARS-CoV-2 не только не погибали, но и не проявляли клинических признаков заболевания, в отличие от животных контрольной группы. Att-фенотип са-вируса подтверждался отсутствием выраженной гистопатологии в лёгких мышей и сниженной репродукцией во внутренних органах по сравнению с диким вирусом на 6-е сутки после иммунизации.
В работе, выполненной в ФГБНУ НИИ вакцин и сывороток им. И.И. Мечникова, описана аттенуация штамма Dubrovka (штамм D) SARS-CoV-2 путём холодовой адаптации (постепенное понижение температуры культивирования в течение 42 пассажей до 23ºC) в клетках Vero CCL-81 [32]. Получены 2 ca-клона штамма D: вариант D-D2, обладающий ts-фенотипом и способный к размножению в клетках лёгких человека Calu-3; и вариант D-B4, не обладающий ts-фенотипом, но утративший способность размножаться в клетках лёгких человека Calu-3. Полногеномная генетическая характеристика вариантов D-D2 и D-B4 выявила до 20 нуклеотидных и 18 аминокислотных замен по сравнению с родительским штаммом. При интраназальном заражении сирийских хомяков оба са-варианта показали сниженную вирулентность — не замедляли прирост массы тела, достоверно медленнее размножались в лёгких и других органах, вызывали значительно менее выраженные воспалительные изменения в лёгких по сравнению со штаммом D. Таким образом, установлено, что для ca-вариантов SARS-CoV-2 ts-фенотип не является обязательным условием снижения вирулентности. Так, вариант D-B4, не обладавший ts-фенотипом, но утративший способность заражать клетки лёгких человека Calu-3, также проявлял пониженную вирулентность для хомяков [23].
J. Xu и соавт. проводили аттенуацию SARS-CoV-2, пассируя вирус в культуре клеток Vero E6 при постепенно понижаемой температуре. При достижении 21ºC было проведено 5 пассажей с последующим клонированием и определением температурной чувствительности. В результате был выбран клон TS11, обладающий ca- и ts-фенотипами. Полногеномный анализ клона TS11 показал появление делеции, приводящей к выпадению участка белка в 12 аминокислот, захватывающего сайт расщепления S-белка фурином, и делеции в 371 нуклеотид, захватывающей гены ORF7b–ORF8, а также нескольких точечных мутаций в генах nsp16, S, E, orf7a и N. При интраназальном заражении клоном TS11 сирийские хомяки продолжали набирать массу и не демонстрировали признаков заболевания. TS11 хорошо реплицировался в полости носа, но не в лёгких, вызывая в них лишь незначительные поражения. К 20-му дню после иммунизации при гистологическом исследовании следов воспаления в лёгких не обнаруживалось [24].
M. Abdoli и соавт. также получали ca-мутант SARS-CoV-2, пассируя вирус в культуре клеток Vero при постепенно понижаемой температуре. Авторы предполагают, что аттенуацию полученного штамма KaraVac определила двойная делеция в S-белке: на стыке S1/S2 (мотив PRRA) и в сайте S1-NTD (мотив GTNGTKR). Штамм KaraVac размножался при температурах 25ºC, 33ºC и 39ºC, но не при 41ºC. Иммунизированные сирийские хомяки по сравнению с контрольной группой, заражённой диким штаммом, не теряли массу тела и не проявляли других признаков заболевания [22].
Вместе с тем X.-F. Li и соавт. получили аттенуированный вариант SARS-CoV-2, проводя серийные пассажи на культуре клеток Vero при температуре 37ºC для получения материала для инактивированной вакцины. Полученный штамм получил название VAS5 и имел делецию в 21 нуклеотид, кодирующий 7 аминокислот перед сайтом расщепления S1/S2, в S-гене. В культурах клеток Caco-2 и Huh7 и органоидах лёгочного эпителия человека штамм VAS5 размножался значительно медленнее, чем «дикий». Иммунизированные мыши линии K18-hACE2 не теряли массы тела, патологические изменения в лёгких не обнаруживались, в гомогенатах лёгких выявлены единичные копии РНК [13].
Генно-инженерные подходы к аттенуации SARS-CoV-2
Получение аттенуированного вируса классическими вирусологическими методами может занять несколько месяцев, что является критичным в условиях пандемии. С развитием методов генной инженерии появились новые подходы к быстрому созданию вакцинных штаммов с применением методов сайт-направленного мутагенеза [34–36] или деоптимизации кодонов [37, 38]. Так, на вирусе гепатита мышей (Murine coronavirus, ранее Murine hepatitis virus) — хорошо изученном модельном коронавирусе — показано, что высококонсервативные для различных коронавирусов последовательности генов неструктурных белков NSP14 и NSP16 являются универсальными мишенями для сайт-направленного мутагенеза, нацеленного на снижение вирулентности вируса. Внесение даже единичной аминокислотной замены приводило к появлению выраженной аттенуации вируса для мышей. При этом иммунизация мышей мутантным вирусом обеспечивала формирование длительного гуморального и выраженного CD4+- и CD8+-T-клеточного иммунного ответа и полноценную защиту от заражения летальной дозой вируса [39].
Z.W. Ye и соавт. также использовали в качестве мишени ген NSP16 SARS-CoV-2, внеся в него мутацию D130A. Белок NSP16 является антагонистом интерферонов типа I и критически важен для метилирования 5’-кэп структуры вирусных мРНК, а точечная мутация D130A приводит к инактивации метилтрансферазной активности NSP16. Мутантный штамм d16 в процессе длительного пассирования на культуре клеток Vero E6 оставался генетически стабильным и не проявлял признаков реверсии вирулентности. При экспериментальном заражении штаммом d16 у сирийских хомяков и мышей линии K18-hACE2 не наблюдалось потери массы тела и не развивалось заболевание [20].
Y. Liu и соавт. использовали в качестве мишени гены акцессорных белков SARS-CoV-2, поскольку они связаны с регуляцией репродукции вируса через взаимодействие с сигнальными путями хозяина. Гены акцессорных белков ORF3, ORF6, ORF7 и ORF8 были удалены из генома, а фрагмент регуляторной транскрипционной последовательности TRS ACGAAC был заменён на CCGGAT. Аттенуированный таким образом вирус ∆3678 хуже размножался в первичной культуре клеток эпителия лёгких человека по сравнению с родительским штаммом, но сохранял способность к репродукции в культуре Vero E6. В экспериментах на мышах линии BALB/c роль каждого гена в аттенуации SARS-CoV-2 была изучена с использованием адаптированного к мышам штамма SARS-CoV-2. В результате показано, что делеция ORF3 (∆3a) играет важную роль в аттенуации вируса ∆3678, связанную, по предположению авторов, с влиянием продукта ORF3 на сигнальный путь интерферона I типа. Иммунизированные интраназально штаммом ∆3678 сирийские хомяки не теряли массы тела, а вирусная нагрузка в смывах из носоглотки, трахеи и лёгких была значительно ниже, чем у контрольной группы, заражённой диким штаммом. Мыши линии K18-hACE2 после иммунизации не теряли массы тела и не погибали даже при введении высокой дозы аттенуированного вируса [18]. Аналогичный результат получен в работе Zi-Wei Ye и соавт. [20].
Для получения аттенуированного штамма S. Liu и соавт. внесли в геном SARS-CoV-2 (изолят WA1/2020) следующие модификации: удалили последовательность, кодирующую пептид PRRA перед сайтом расщепления фурина, удалили ORFs6-8, которые являются антагонистами интерферонов, внесли мутации K164A/H165A в C-концевой домен белка NSP1. Полученный штамм WA1-ΔPRRA-ΔORF6-8-Nsp1N128S/K129E хуже размножался, чем исходный вирус, в культуре клеток эпителия трахеи и бронхов человека MatTek EpiAirway и при заражении вызывал лишь слабовыраженные поражения лёгких у трансгенных мышей K18-hACE2 и сирийских хомяков [19].
Несколько другой подход использовали A. Yoshida и соавт. [17]. При помощи методов обратной генетики они получили библиотеку из 659 мутантных клонов на основе клинического изолята SARS-CoV-2 линии B.1.1 (Pango). Далее с целью выявления ts-фенотипа культивировали клоны в двух температурных режимах — 32ºС и 37ºС, отбирая для дальнейшей работы клоны, не проявлявшие цитопатическое действие при 37ºС. Экспериментальное заражение сирийских хомяков также подтвердило att-фенотип отобранных ts-штаммов, который проявлялся в отсутствии потери массы тела, снижении репродуктивной активности вируса в респираторном тракте, менее выраженном воспалении лёгких по сравнению с исходным штаммом [17].
В ряде работ для аттенуации SARS-CoV-2 использовалась технология деоптимизации кодонов, заключающаяся в замене кодонов на субоптимальные без изменения аминокислотных последовательностей вирусных белков [38]. Подобные изменения напрямую влияют на скорость синтеза вирусных белков и репликации генома, определяя аттенуацию вируса [38]. J. Trimpert и соавт., используя данный метод, перекодировали бóльшую часть геномной последовательности SARS-CoV-2, получив несколько кандидатных вакцинных штаммов. Для деоптимизации выбирались кодоны, редко встречающиеся в геноме человека. Выбранные для дальнейшей работы штаммы sCDP9 и sCDP10 хуже размножались в культуре клеток, чем исходный штамм, и оставались генетически стабильными на протяжении 10 пассажей в культуре клеток Vero E6. При интраназальной иммунизации сирийские хомяки незначительно теряли массы тела, но быстро её восстанавливали, не проявляли признаков заболевания, имели меньшие воспалительные изменения в лёгких [15].
На основе технологии деоптимизации кодонов американской компанией «Codagenix» была разработана вакцина CoviLiv [16]. Мишенью для деоптимизации служил S-ген. После иммунизации вакцинным штаммом сирийские хомяки не теряли массы тела, при гистологическом исследовании лёгких на 6-й день патология ограничивалась минимальными воспалительными изменениями. Инфекционный титр в лёгких хомяков определялся на пределе чувствительности метода, что свидетельствует о крайне низкой репродуктивной активности вакцинного штамма в лёгких.
В таблице в обобщённом виде представлен опыт разных научных групп в получении аттенуированных вариантов SARS-CoV-2.
Методические подходы к аттенуации SARS-CoV-2 при интраназальном введении / Methodological approaches to SARS-CoV-2 attenuation after intranasal administration
Название штамма Strain name | Стратегия аттенуации Attenuation strategy | Животная модель, на которой установлен att-фенотип Animal model on which the att phenotype was established | Источник Reference |
D-D2 и D-B4 | Холодовая адаптация в культуре клеток Vero до 23ºС Cold adaptation in Vero cell culture up to 23ºС | Сирийские золотистые хомяки Syrian golden hamsters | [23] |
CoV-2-CNUHV03-CA22⁰C | Холодовая адаптация в культуре клеток Vero до 22ºС Cold adaptation in Vero cell culture up to 22⁰С | K18-hACE2 мыши K18-hACE2 mice | [21] |
Δ3678 | Удаление генов акцессорных белков ORF3, ORF6-8, замена ACGAAC на CCGGAT в регуляторной транскрипционной последовательности ORF3, ORFs6-8 deletion, changing ACGAAC to CCGGAT in TRS | K18-hACE2 мыши, сирийские золотистые хомяки K18-hACE2 mice, Syrian golden hamsters | [18] |
KaraVac | Холодовая адаптация в культуре клеток Vero до 25ºС Cold adaptation in Vero cell culture up to 25ºС | Сирийские золотистые хомяки Syrian golden hamsters | [22] |
sCPD9 и sCPD10 | Деоптимизация кодонов в большей части генома SARS-CoV-2 Codon-pair deoptimization | Сирийские хомяки, хомячки Роборовского Syrian hamsters, Roborovski dwarf hamster | [15] |
VAS5 | Пассирование в культуре клеток Vero Serial passages in Vero cell culture | K18-hACE2 мыши, хомяки K18-hACE2 mice, hamsters | [13] |
TS11 | Холодовая адаптация в культуре клеток до 21ºС Cold adaptation in Vero cell culture up to 21ºС | Сирийские золотистые хомяки Syrian golden hamsters | [24] |
CoviLiv (COVI-VAC) | Деоптимизация кодонов в гене S-белка Codon-pair deoptimization of S-gene | Сирийские золотистые хомяки Syrian golden hamsters | [16] |
rTS-all | Внесение случайных мутаций и конструирование методами обратной генетики вируса, несущего все необходимые ts-мутации Random mutagenesis and generation by reverse genetic methods strain with all nessessary ts-related mutations | Сирийские золотистые хомяки Syrian golden hamsters | [17] |
WA1-ΔPRRA-ΔORF6-8-Nsp1K164A/H165A | Удаление генов ORFs6-8, удаление последовательности PRRA перед сайтом расщепления фурина, внесение мутации K164A/H165A в C-концевой домен белка NSP1 ORFs6-8 deletion, removing PRRA upstream of the furin cleavage site, introducing K164A/H165A into the C-terminus of NSP1 | K18-hACE2 мыши, сирийские золотистые хомяки K18-hACE2 mice, Syrian golden hamsters | [19] |
d16 | Внесение мутации D130A в ген NSP16 Point mutation D130A in NSP16 gene | K18-hACE2 мыши, сирийские золотистые хомяки K18-hACE2 mice, Syrian golden hamsters | [20] |
Иммуногенный потенциал живых аттенуированных вакцин против COVID-19
Протективная активность большинства лицензированных вакцин против COVID-19, направленных на формирование гуморального иммунитета, обусловлена индукцией нейтрализующих антител к неструктурному поверхностному S-белку SARS-CoV-2 (рис. 2, а). Однако возникающее при массовой иммунизации давление искусственного отбора делает данную мишень очень изменчивой, что приводит к ускользанию вируса от иммунологического надзора и быстрому снижению эффективности вакцин против вновь возникающих вариантов SARS-CoV-2 [6, 7]. Эти вакцины не обеспечивают возникновение стерилизующего иммунитета [40] и формирование полноценного мукозального иммунитета [41].
Рис. 2. Механизмы формирования иммунного ответа при внутримышечной иммунизации вакциной, содержащей S-белок, и интраназальной вакцинацией ЖАВ. а — вакцины против COVID-19, основанные на S-белке SARS-CoV-2 (на примере векторной вакцины), индуцируют только гуморальный ответ с образованием вируснейтрализующих антител; б — ЖАВ запускает такие же механизмы с формированием приобретённого иммунитета, что и при естественном заражении, включая активацию не только гуморального, но и клеточного иммунитета. Вакцинный штамм при интраназальном введении заражает эпителиальные клетки верхнего отдела дыхательных путей, при этом индуцируется как местный (мукозальный), так и системный иммунный ответ. Образовывающаяся при этом защита, включающая клеточные и гуморальные звенья, обеспечивает формирование иммунитета как на уровне входных ворот инфекции (слизистые), так и на системном уровне. в/м — внутримышечное введение; и/н — интраназальное введение; APC — antigen-presenting cell, антигенпрезентирующая клетка; CTL — cytotoxic lymphocyte, цитотоксический лимфоцит; MHC — major histocompatibility complex, главный комплекс гистосовместимости. / Fig. 2. Mechanisms of induction of an immune response by the intramuscular immunization vaccine containing the S protein and by intranasal vaccination of LAV. a — vaccines against COVID-19, which are based on the S protein of SARS-CoV-2 (using the example of the viral vector vaccine), induce only a humoral response involving production of virus-neutralizing antibodies; b — LAV triggers the mechanisms inducing acquired immunity, which are similar to those engaged in natural infection, including activation not only humoral, but also cell-mediated immunity. In intranasal administration, the vaccine strain infects epithelial cells of the upper respiratory tract, thus inducing both local (mucosal) and systemic immune responses. The established protection including cellular and humoral components provides immunity both at the level of the entrance gate of the infection (mucosa) and at the systemic level. i/m — intramuscular injection; i/n — intranasal; APC — antigen-presenting cell; CTL — cytotoxic lymphocyte; MHC — major histocompatibility complex.
При естественном заражении вирусом SARS-CoV-2 иммунный ответ формируется против всех вирусных белков — как структурных, так и неструктурных. Структурные белки М и N являются высокоиммуногенными и, вместе с неструктурными белками, более консервативны, чем S-белок. Кроме того, многие Т-клеточные эпитопы филогенетически родственных видов коронавирусов и различных вариантов SARS-CoV-2 располагаются не в S-белке [42, 43]. Если при инфицировании человека происходит эффективный Т-клеточный иммунный ответ, системная воспалительная реакция не развивается, в результате чего заболевание приобретает лёгкое, а в ряде случаев бессимптомное течение. Если развитие Т-клеточного (и как результат — гуморального) ответа затягивается, начинают доминировать факторы врождённого иммунитета, проявляясь на системном уровне, что приводит к тяжёлому течению заболевания [44]. Нужно также отметить, что протективность Т-клеточного иммунитета меньше зависит от мутаций, возникающих при формировании новых вариантов SARS-CoV-2, поскольку он таргетирован в том числе на более консервативные вирусные антигены [45, 46].
В основе протективной активности ЖАВ для интраназального применения (мукозальных вакцин) лежат те же механизмы, что и участвующие в формировании приобретённого иммунитета при естественном заражении (рис. 2, б). Когда респираторный вируc проникает в носовую и/или ротовую полости, лимфоидные ткани, ассоциированные со слизистой оболочкой респираторного и пищеварительного трактов, становятся первой линией защиты против вирусной инфекции. В этот процесс вовлекаются все компоненты врождённого иммунитета верхних дыхательных путей — как клеточные (нейтрофилы, макрофаги, дендритные клетки, резидентные микроскладчатые М-клетки, врождённые лимфоидные клетки, естественные киллеры и тучные клетки), так и растворимые молекулы (галектины, коллектины, цитокины и др.). После запуска первой линии защиты происходит активация дендритных клеток в очаге инфекции, они поглощают, процессируют и презентируют вирусные антигены. Такие активированные дендритные клетки, «нагруженные» вирусными антигенами, мигрируют в регионарные лимфатические узлы, происходит презентация антигенов наивным Т-клеткам, что запускает их дальнейшую дифференцировку и активацию адаптивного иммунитета с формированием цитотоксических Т-лимфоцитов и Т-хелперов. Специфические наивные В-лимфоциты распознают вирусные антигены либо самостоятельно, либо при их презентации фолликулярными дендритными клетками в виде комплекса антиген–антитело посредством Fc-рецептора. Взаимодействие активированных Т-хелперов и В-лимфоцитов приводит к запуску гуморального иммунного ответа. Именно одновременная экспансия CD4+-Т-хелперов, CD8+-цитотоксических Т-клеток в очаге инфекции и продукция антител плазматическими клетками имеет решающее значение для элиминации вируса [41, 47, 48]. Сочетанная активация гуморального и клеточного звеньев системной и мукозальной иммунной защиты способна обеспечивать эффективную защиту от инфекции SARS-CoV-2 [47].
В медицинской практике применяются разные способы введения ЖАВ: вакцины против кори, краснухи, эпидемического паротита и ветряной оспы вводятся внутримышечно; полиомиелитная и ротавирусная вакцина — перорально; ЖГВ — интраназально. Разработчики ЖАВ против COVID-19 применяют интраназальный способ введения [15–24]. Разные способы введения имеют свои преимущества и недостатки. Так, интраназальное и пероральное введение обеспечивает не только индукцию системного клеточного и гуморального адаптивного иммунного ответа, но и формирование мукозального (местного) иммунитета, включая секрецию специфических IgA-антител в слизистой оболочке дыхательных путей или кишечника. При интраназальной иммунизации с последующим заражением вирулентным штаммом специфические секреторные IgA-антитела нейтрализуют вирус непосредственно на слизистой оболочке респираторного тракта, являющейся «входными воротами» инфекции, подавляя его адгезионную способность и снижая эффективность трансмиссии [47]. Вместе с тем при интраназальном введении недостаточно аттенуированного вируса существует риск поражения центральной нервной системы через обонятельные нервы [48]. Для ЖАВ, которые вводятся внутримышечно, риск поражения мозга отсутствует, при этом уровень сероконверсии после второй иммунизации достигает 95–100% [49, 50]. R. Mehla и соавт. показали, что при интраназальном введении вакцинного штамма SARS-CoV-2 титр нейтрализующих антител в сыворотке крови был достоверно выше, чем при внутримышечном введении [51].
Несмотря на то, что, по данным ВОЗ1, вакцина CoviLiv находится на III фазе клинических испытаний, доступные данные по безопасности и эффективности ЖАВ против COVID-19 для людей отсутствуют. В то же время на официальном сайте разработчика вакцины уже есть анонс скорого появления такого отчёта2. В нём отмечается, что живая аттенуированная интраназальная вакцина против COVID-19 CoviLiv является иммуногенной, хорошо переносится здоровыми взрослыми, а также индуцирует протективный клеточный иммунитет в отношении всех известных вариантов SARS-CoV-2. В испытаниях приняли участие 48 взрослых здоровых людей. В пресс-релизе компании говорится, что испытания вакцины являются частью программы ВОЗ «Объединяющие экспериментальные вакцины», направленной на поддержку разработки вакцин против COVID-19 второго поколения, обладающих большей эффективностью в отношении новых эпидемиологически значимых вариантов, большей продолжительностью защиты, упрощёнными условиями хранения и безыгольным способом введения.
Иммуногенность и протективная активность ЖАВ хорошо исследована только на животных моделях коронавирусной инфекции. Основными моделями для доклинического изучения аттенуированных мутантов SARS-CoV-2 являлись золотистые сирийские хомяки (Mesocricetus auratus), хомячок Роборовского (Phodopus roborovskii) и линия трансгенных мышей K18-hACE2. В большинстве работ у иммунизированных животных наблюдалось развитие протективного иммунного ответа против родительского штамма SARS-CoV-2, использованного для получения аттенуированного штамма. Так, иммунизированные аттенуированным вирусом сирийские хомяки при экспериментальном заражении родительским штаммом не теряли массы тела, не проявляли клинических признаков заболевания, а титрование носовых смывов и гомогенатов лёгких показало более низкий титр вируса, чем у животных контрольной группы [17, 18, 22, 23]. J. Trimpert и соавт. отметили, что в образцах лёгких иммунизированных животных на 2-е, 3-и и 5-е сутки после экспериментального заражения инфекционной активности не обнаруживалось, что свидетельствует о формировании стерилизующего иммунитета [15, 52]. J. Xu и соавт. также отметили, что иммунизированные ts-штаммом хомяки не демонстрировали никаких признаков инфекции, даже несмотря на случайное перекрёстное заражение от животных, инфицированных диким штаммом [24]. Y. Liu и соавт. отметили, что однократная интраназальная иммунизация сирийских хомяков att-штаммом Δ3678 SARS-CoV-2 не только защищала их от заражения вирулентным штаммом, но и снижала вероятность трансмиссии вируса [18]. S.H. Seo и соавт. в своей работе обнаружили, что иммунизированные ca-штаммом мыши линии K18-hACE2 не только выжили при экспериментальном заражении, но и не теряли в массе и не имели клинических признаков заболевания [21].
X.-F. Li и соавт. также оценивали вероятность передачи вируса SARS-CoV-2 от ранее иммунизированных животных при их заражении. Иммунизированных хомяков на следующий день после заражения помещали в клетки с хомяками, ранее не иммунизированными и не имевшими контакта с вирусом, на 3-и и 5-е сутки делали смывы. У неиммунных хомяков на 3-и сутки РНК вируса определялась на пределе чувствительности ПЦР, на 5-е сутки РНК не обнаруживалась, что свидетельствует об отсутствии трансмиссии вируса при близком контакте с иммунизированными и заражёнными хомяками [13].
В то же время в работе S. Liu и соавт. указаны возможные ограничения по использованию модели на основе мышей K18-hACE2 при оценке иммуногенности: вызываемый заражением att-SARS-CoV-2 энцефалит с последующей гибелью животных затрудняет интерпретацию результатов. Для компенсации данного ограничения образцы носовых ходов, лёгких и мозга отбирались на 2, 4 и 6-е сутки после заражения для определения вирусной нагрузки. Любопытно, что даже максимально аттенуированный штамм WA1-ΔPRRA-ΔORF6-8-Nsp1N128S/K129E остался нейротропным и определялся в мозге мышей K18-hACE2 на высоком уровне на 6-е сутки после заражения [19]. В исследованиях, проведённых на сирийских хомяках, att-штаммы SARS-CoV-2 не проявляли столь высокой нейротропности и патологических изменений в головном мозге.
ЖАВ против SARS-CoV-2 имеют высокий потенциал перекрёстной протективной активности в отношении различных вариантов возбудителя именно благодаря запуску тех же механизмов, что и при естественном заражении вирусом. Так, естественно перенесённая инфекция SARS-CoV-2 предотвращала до 90% случаев реинфекции вариантами Alpha, Beta или Delta [53, 54] и 56% случаев реинфекции вариантом Omicron [55]. Большинство случаев реинфекции происходило спустя год после первичного заболевания [55]. Реинфекция стала обычным явлением с момента появления варианта Omicron и дальнейшей его эволюции. Исследование, проведенное в Катаре, показывает, что заражение человека вариантами SARS-CoV-2, предшествующими Omicron, обеспечивало менее 60% защиты от повторного заражения субвариантами Omicron. В то же время защитная эффективность первичной инфекции от развития тяжёлой формы заболевания или летального исхода при повторном заражении вариантом Omicron составила 97,3% (95% ДИ 94,9–98,6%) независимо от варианта вируса, вызвавшего первичную инфекцию [56]. Чрезвычайно низкая доля тяжёлых и летальных случаев при повторном заражении даёт надежду на то, что ЖАВ против COVID-19 смогут обеспечить перекрестную защиту от различных вариантов вируса.
J. Trimpert и соавт. экспериментально показали, что при заражении att-штаммами SARS-CoV-2 у лабораторных животных формируется иммунитет, обеспечивающий перекрёстную защиту. После иммунизации att-Ухань-подобным штаммом авторы заражали хомячков Роборовского циркулировавшими на момент постановки эксперимента вариантами вируса Alpha и Beta. Однократной интраназальной иммунизации оказалось достаточно для формирования защиты при заражении не только родительским штаммом вируса, но и неродственными вариантами Alpha и Beta [52]. Этими же авторами было подтверждено формирование иммунитета, обеспечивающего перекрёстную защиту, при иммунизации сирийских хомяков att-штаммом sCPD9 и последующем заражении штаммом Delta [57].
A. Yoshida и соавт. иммунизированных интраназально аттенуированным и родительским штаммами SARS-CoV-2 линии B.1.1 (Ухань-подобный) хомяков заражали вариантом Omicron (линия BA.1). В носовых смывах и гомогенатах лёгких у иммунизированных хомяков инфекционный титр вируса определялся на пределе чувствительности метода и достоверно не отличался независимо от выбранного для иммунизации штамма, что свидетельствовало о развитии перекрёстной защиты, в том числе против филогенетически отдалённых штаммов [17].
Однако в работе J. Ma и соавт. при иммунизации хомяков дикими штаммами вариантов Beta и Omicron линии BA.1 и последующим заражением Ухань-подобным, Beta, Delta и Omicron BA.1 была выявлена слабая перекрёстная активность антител при заражении гетерологичными штаммами. При этом заражение хомяков, ранее инфицированных Omicron, гетерологичными по отношению к Omicron штаммами оказало бустерный эффект на синтез нейтрализующих антител [58]. Таким образом, по мнению авторов, двукратное заражение гетерологичными штаммами обеспечивает выраженный противовирусный иммунный ответ, что следует учитывать при разработке схем вакцинации.
Заключение
Большинство исследований, проведённых на животных моделях COVID-19, показали безопасность и высокую эффективность интраназальной иммунизации животных att-вариантами SARS-CoV-2 независимо от избранной стратегии аттенуации вируса. В пилотных экспериментах подтверждена гипотеза о протективной активности att-штаммов SARS-CoV-2 в отношении гетерологичных антигенных вариантов вируса. Представленные в исследованиях данные о вирулентности и иммуногенности кандидатных вакцинных штаммов, полученные на животных моделях, сложно напрямую экстраполировать на человека без проведения клинических исследований. Тем не менее, несмотря на это ограничение, накопленный на сегодняшний день опыт показывает большой потенциал создания высокоэффективной ЖАВ против COVID-19.
Источник финансирования. Исследование выполнено за счёт гранта Российского научного фонда № 23-25-00146, https://rscf.ru/project/23-25-00146/
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
1 URL: https://covid19.who.int
2 URL: https://codagenix.com
Об авторах
Екатерина Романовна Корчевая
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Автор, ответственный за переписку.
Email: c.korchevaya@gmail.com
ORCID iD: 0000-0002-6417-3301
м.н.с., лаб. прикладной вирусологии
Россия, МоскваАнастасия Вячеславовна Грачева
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: c.korchevaya@gmail.com
ORCID iD: 0000-0001-8428-4482
н.с., лаб. прикладной вирусологии
Россия, МоскваИлья Николаевич Дьяков
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: c.korchevaya@gmail.com
ORCID iD: 0000-0001-5384-9866
к.б.н., зав. лаб. биосинтеза иммуноглобулинов
Россия, МоскваВиталий Васильевич Зверев
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: c.korchevaya@gmail.com
ORCID iD: 0000-0001-5808-2246
д.б.н., профессор, академик РАН, научный руководитель
Россия, МоскваЕвгений Бахтиерович Файзулоев
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова; Российская медицинская академия непрерывного профессионального образования
Email: c.korchevaya@gmail.com
ORCID iD: 0000-0001-7385-5083
к.б.н., зав. лаб. прикладной вирусологии
Россия, Москва; МоскваСписок литературы
- Teo S.P. Review of COVID-19 mRNA vaccines: BNT162b2 and mRNA-1273. J. Pharm. Pract. 2022;35(6):947–51. DOI: DOI: https://doi.org/10.1177/08971900211009650
- Wang H., Zhang Y., Huang B., et al. Development of an inactivated vaccine candidate, BBIBP-CorV, with potent protection against SARS-CoV-2. Cell. 2020;182(3):713–21.e9. DOI: https://doi.org/10.1016/j.cell.2020.06.008
- Wu Z., Hu Y., Xu M., et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect. Dis. 2021;21(6):803–12. DOI: https://doi.org/10.1016/S1473-3099(20)30987-7
- Al-Sheboul S.A., Brown B., Shboul Y., et al. An immunological review of SARS-CoV-2 infection and vaccine serology: innate and adaptive responses to mRNA, adenovirus, inactivated and protein subunit vaccines. Vaccines (Basel). 2022;11(1):51. DOI: https://doi.org/10.3390/vaccines11010051
- Khoshnood S., Arshadi M., Akrami S., et al. An overview on inactivated and live-attenuated SARS-CoV-2 vaccines. J. Clin. Lab. Anal. 2022;36:e24418. DOI: https://doi.org/10.1002/jcla.24418
- Bowen J.E., Addetia A., Dang H.V., et al. Omicron spike function and neutralizing activity elicited by a comprehensive panel of vaccines. Science. 2022;377(6608):890–4. DOI: https://doi.org/10.1126/science.abq0203
- Dejnirattisai W., Huo J., Zhou D., et al. SARS-CoV-2 Omicron-B.1.1.529 leads to widespread escape from neutralizing antibody responses. Cell. 2022;185(3):467–84.e15. DOI: https://doi.org/10.1016/j.cell.2021.12.046
- Feikin D.R., Higdon M.M., Abu-Raddad L.J., et al. Duration of effectiveness of vaccines against SARS-CoV-2 infection and COVID-19 disease: results of a systematic review and meta-regression. Lancet. 2022;399(10328):924–44. DOI: https://doi.org/10.1016/S0140-6736(22)00152-0
- Chen J.M. Should the world collaborate imminently to develop neglected live-attenuated vaccines for COVID-19? J. Med. Virol. 2022;94(1):82–7. DOI: https://doi.org/10.1002/jmv.27335
- Goławski M., Lewandowski P., Jabłońska I., Delijewski M. The reassessed potential of SARS-CoV-2 attenuation for COVID-19 vaccine development – a systematic review. Viruses. 2022;14(5):991. DOI: https://doi.org/10.3390/v14050991
- Minor P.D. Live attenuated vaccines: Historical successes and current challenges. Virology. 2015;479-480:379–92. DOI: https://doi.org/10.1016/j.virol.2015.03.032
- Zimmerman L.A., Reef S.E., Orenstein W.A. Rubella vaccine-a tale of appropriate caution and remarkable success. JAMA Pediatr. 2018;172(1):95–6. DOI: https://doi.org/10.1001/jamapediatrics.2017.4178
- Li X.F., Cui Z., Fan H., et al. A highly immunogenic live-attenuated vaccine candidate prevents SARS-CoV-2 infection and transmission in hamsters. Innovation (Camb.). 2022;3(2):100221. DOI: https://doi.org/10.1016/j.xinn.2022.100221
- Maassab H.F., DeBorde D.C. Development and characterization of cold-adapted viruses for use as live virus vaccines. Vaccine. 1985;3(5):355–69. DOI: https://doi.org/10.1016/0264-410x(85)90124-0
- Trimpert J., Dietert K., Firsching T.C., et al. Development of safe and highly protective live-attenuated SARS-CoV-2 vaccine candidates by genome recoding. Cell Rep. 2021;36(5):109493. DOI: https://doi.org/10.1016/j.celrep.2021.109493
- Wang Y., Yang C., Song Y., et al. Scalable live-attenuated SARS-CoV-2 vaccine candidate demonstrates preclinical safety and efficacy. Proc. Natl Acad. Sci. USA. 2021;118(29):e2102775118. DOI: https://doi.org/10.1073/pnas.2102775118
- Yoshida A., Okamura S., Torii S., et al. Versatile live-attenuated SARS-CoV-2 vaccine platform applicable to variants induces protective immunity. iScience. 2022;25(11):105412. DOI: https://doi.org/10.1016/j.isci.2022.105412
- Liu Y., Zhang X., Liu J., et al. A live-attenuated SARS-CoV-2 vaccine candidate with accessory protein deletions. Nat. Commun. 2022;13(1):4337. DOI: https://doi.org/10.1038/s41467-022-31930-z
- Liu S., Stauft C.B., Selvaraj P., et al. Intranasal delivery of a rationally attenuated SARS-CoV-2 is immunogenic and protective in Syrian hamsters. Nat. Commun. 2022;13(1):6792. DOI: https://doi.org/10.1038/s41467-022-34571-4
- Ye Z.W., Ong C.P., Tang K., et al. Intranasal administration of a single dose of a candidate live attenuated vaccine derived from an NSP16-deficient SARS-CoV-2 strain confers sterilizing immunity in animals. Cell Mol. Immunol. 2022;19(5):588–601. DOI: https://doi.org/10.1038/s41423-022-00855-4
- Seo S.H., Jang Y. Cold-adapted live attenuated SARS-Cov-2 vaccine completely protects human ACE2 transgenic mice from SARS-Cov-2 infection. Vaccines (Basel). 2020;8(4):584. DOI: https://doi.org/10.3390/vaccines8040584
- Abdoli M., Shafaati M., Ghamsari L.K., Abdoli A. Intranasal administration of cold adapted live-attenuated SARS-CoV-2 candidate vaccine confers protection against SARS-CoV-2. Virus Res. 2022;319:198857.
- Faizuloev E., Gracheva A., Korchevaya E., et al. Cold-adapted SARS-CoV-2 variants with different temperature sensitivity exhibit an attenuated phenotype and confer protective immunity. Vaccine. 2022;41(4):892–902. DOI: https://doi.org/10.1016/j.vaccine.2022.12.019
- Xu J., Liu M., Niu X., et al. The cold-adapted, temperature-sensitive SARS-CoV-2 strain TS11 is attenuated in syrian hamsters and a candidate attenuated vaccine. Viruses. 2023;15(1):95. DOI: https://doi.org/10.3390/v15010095
- Hilleman M.R., Buynak E.B., Weibel R.E., et al. Development and evaluation of the Moraten measles virus vaccine. JAMA. 1968;206(3):587–90.
- Plotkin S.A., Buser F. History of RA27/3 rubella vaccine. Rev. Infect. Dis. 1985;7(Suppl. 1):S77–8. DOI: https://doi.org/10.1093/clinids/7.supplement_1.s77
- Maassab H.F. Adaptation and growth characteristics of influenza virus at 25 degrees c. Nature. 1967;213(5076):612–4. DOI: https://doi.org/10.1038/213612a0
- Smorodintsen A.A., Alexandrova G.A., Chalkova O.U., Selivanov A.A. Experiences in the development of live vaccines against influenza and influenza-like respiratory infections. Ind. Med. Surg. 1965;34:53–64.
- Ghendon Y.Z., Polezhaev F.I., Lisovskaya K.V., et al. Recombinant cold-adapted attenuated influenza A vaccines for use in children: molecular genetic analysis of the cold-adapted donor and recombinants. Infect. Immun. 1984;44(3):730–3. DOI: https://doi.org/10.1128/iai.44.3.730-733.1984
- Murphy B.R., Coelingh K. Principles underlying the development and use of live attenuated cold-adapted influenza A and B virus vaccines. Viral Immunol. 2002;15(2):295–323. DOI: https://doi.org/10.1089/08828240260066242
- Maassab H.F., Bryant M.L. The development of live attenuated cold-adapted influenza virus vaccine for humans. Rev. Med. Virol. 1999;9(4):237–44. DOI: https://doi.org/10.1002/(sici)1099-1654(199910/12)9:4 < 237::aid-rmv252 > 3.0.co;2-g
- Файзулоев Е.Б., Корчевая Е.Р., Грачева А.В. и др. Биологическая характеристика холодоадаптированных вариантов коронавируса SARS-CoV-2. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(4):397–409. Faizuloev E.B., Korchevaya E.R., Gracheva A.V., et al. Biological characterization of cold-adapted SARS-CoV-2 variants. Journal of Microbiology, Epidemiology and Immunobiology. 2022;99(4):397–409. DOI: https://doi.org/10.36233/0372-9311-280. EDN: https://elibrary.ru/llgegh
- Грачева А.В., Корчевая Е.Р., Самойликов Р.В. и др. Маркеры аттенуации холодоадаптированных вариантов коронавируса SARS-CoV-2. Медицинский академический журнал. 2022; 22(2):79–88. Gracheva A.V., Korchevaya E.R., Samoilikov R.V., et al. Attenuation markers of cold-adapted SARS-CoV-2 variants. Medical Academic Journal. 2022;22(2):79–88. DOI: https://doi.org/10.17816/MAJ108725
- Flavell R.A., Sabo D.L., Bandle E.F., Weissmann C. Site-directed mutagenesis: effect of an extracistronic mutation on the in vitro propagation of bacteriophage Qbeta RNA. Proc. Natl Acad. Sci. USA. 1975;72(1):367–71. DOI: https://doi.org/10.1073/pnas.72.1.367
- Shortle D., Nathans D. Local mutagenesis: a method for generating viral mutants with base substitutions in preselected regions of the viral genome. Proc. Natl Acad. Sci. USA. 1978;75(5):2170–4. DOI: https://doi.org/10.1073/pnas.75.5.2170
- Edelheit O., Hanukoglu A., Hanukoglu I. Simple and efficient site-directed mutagenesis using two single-primer reactions in parallel to generate mutants for protein structure-function studies. BMC Biotechnol. 2009;9:61. DOI: https://doi.org/10.1186/1472-6750-9-61
- Coleman J.R., Papamichail D., Skiena S., et al. Virus attenuation by genome-scale changes in codon pair bias. Science. 2008;320(5884):1784–7. DOI: https://doi.org/10.1126/science.1155761
- Groenke N., Trimpert J., Merz S., et al. Mechanism of virus attenuation by codon pair deoptimization. Cell Rep. 2020;31(4):107586. DOI: https://doi.org/10.1016/j.celrep.2020.107586
- Zhang Z., Liu Q., Sun Y., et al. Live attenuated coronavirus vaccines deficient in N7-methyltransferase activity induce both humoral and cellular immune responses in mice. Emerg. Microbes Infect. 2021;10(1):1626–37. DOI: https://doi.org/10.1080/22221751.2021.1964385
- Krammer F. SARS-CoV-2 vaccines in development. Nature. 2020;586(7830):516–27. DOI: https://doi.org/10.1038/s41586-020-2798-3
- Miteva D., Peshevska-Sekulovska M., Snegarova V., et al. Mucosal COVID-19 vaccines: Risks, benefits and control of the pandemic. World J. Virol. 2022;11(5):221–36. DOI: https://doi.org/10.5501/wjv.v11.i5.221
- Mateus J., Grifoni A., Tarke A., et al. Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans. Science. 2020;370(6512):89–94. DOI: https://doi.org/10.1126/science.abd3871
- Grifoni A., Weiskopf D., Ramirez S.I., et al. Targets of T cell responses to SARS-CoV-2 coronavirus in humans with COVID-19 disease and unexposed individuals. Cell. 2020;181(7):1489–501.e15. DOI: https://doi.org/10.1016/j.cell.2020.05.015
- Sette A., Crotty S. Adaptive immunity to SARS-CoV-2 and COVID-19. Cell. 2021;184(4):861–80. DOI: https://doi.org/10.1016/j.cell.2021.01.007
- Tarke A., Sidney J., Kidd C.K., et al. Comprehensive analysis of T cell immunodominance and immunoprevalence of SARS-CoV-2 epitopes in COVID-19 cases. Cell Rep. Med. 2021;2(2):100204. DOI: https://doi.org/10.1016/j.xcrm.2021.100204
- Geers D., Shamier M.C., Bogers S., et al. SARS-CoV-2 variants of concern partially escape humoral but not T-cell responses in COVID-19 convalescent donors and vaccinees. Sci. Immunol. 2021;6(59):eabj1750. DOI: https://doi.org/10.1126/sciimmunol.abj1750
- Nian X., Zhang J., Huang S., et al. Development of nasal vaccines and the associated challenges. Pharmaceutics. 2022;14(10):1983. DOI: https://doi.org/10.3390/pharmaceutics14101983
- Alu A., Chen L., Lei H., et al. Intranasal COVID-19 vaccines: From bench to bed. EBioMedicine. 2022;76:103841. DOI: https://doi.org/10.1016/j.ebiom.2022.103841
- Di Pietrantonj C., Rivetti A., Marchione P., et al. Vaccines for measles, mumps, rubella, and varicella in children. Cochrane Database Syst. Rev. 2021;11(11):CD004407. DOI: https://doi.org/10.1002/14651858.CD004407.pub5
- Ma S.J., Li X., Xiong Y.Q., et al. Combination measles- mumps-rubella-varicella vaccine in healthy children: a systematic review and meta-analysis of immunogenicity and safety. Medicine (Baltimore). 2015;94(44):e1721. DOI: https://doi.org/10.1097/MD.0000000000001721
- Mehla R., Kokate P., Bhosale S.R., et al. A live attenuated COVID-19 candidate vaccine for children: protection against SARS-CoV-2 challenge in hamsters. Vaccines (Basel). 2023; 11(2):255. DOI: https://doi.org/10.3390/vaccines11020255
- Trimpert J., Adler J.M., Eschke K., et al. Live attenuated virus vaccine protects against SARS-CoV-2 variants of concern B.1.1.7 (Alpha) and B.1.351 (Beta). Sci. Adv. 2021;7(49):eabk0172. DOI: https://doi.org/10.1126/sciadv.abk0172
- Deng L., Li P., Zhang X., et al. Risk of SARS-CoV-2 reinfection: a systematic review and meta-analysis. Sci. Rep. 2022;12(1): 20763. DOI: https://doi.org/10.1038/s41598-022-24220-7
- Mao Y., Wang W., Ma J., et al. Reinfection rates among patients previously infected by SARS-CoV-2: systematic review and meta-analysis. Chin. Med. J. (Engl.). 2021;135(2):145–52. DOI: https://doi.org/10.1097/CM9.0000000000001892
- Altarawneh H.N., Chemaitelly H., Hasan M.R., et al. Protection against the omicron variant from previous SARS-CoV-2 infection. N. Engl. J. Med. 2022;386(13):1288–90. DOI: https://doi.org/10.1056/NEJMc2200133
- Chemaitelly H., Nagelkerke N., Ayoub H.H., et al. Duration of immune protection of SARS-CoV-2 natural infection against reinfection. J. Travel Med. 2022;29(8):taac109. DOI: https://doi.org/10.1093/jtm/taac109
- Nouailles G., Adler J.M., Pennitz P., et al. Live-attenuated vaccine sCPD9 elicits superior mucosal and systemic immunity to SARS-CoV-2 variants in hamsters. Nat. Microbiol. 2023;8(5):860–74. DOI: https://doi.org/10.1038/s41564-023-01352-8
- Ma J., Liu X., Zhou M., et al. A heterologous challenge rescues the attenuated immunogenicity of SARS-CoV-2 omicron BA.1 variant in Syrian hamster model. J. Virol. 2023;97(2):e0168422. DOI: https://doi.org/10.1128/jvi.01684-22
Дополнительные файлы