Сравнительная оценка ферментативной и биоцидной активности Candida auris и Candida albicans
- Авторы: Игнатова Н.И.1, Заславская М.И.1, Александрова Н.А.1, Лапшина А.А.1, Махрова Т.В.1, Лукова О.А.1
-
Учреждения:
- Приволжский исследовательский медицинский университет
- Выпуск: Том 100, № 3 (2023)
- Страницы: 203-209
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/15836
- DOI: https://doi.org/10.36233/0372-9311-301
- EDN: https://elibrary.ru/pdznge
- ID: 15836
Цитировать
Полный текст
Аннотация
Введение. Важную роль в реализации патогенности Candida spp. играют секретируемые продукты метаболизма, обладающие ферментативными или токсическими свойствами. Наиболее клинически значимым видом считается C. albicans, однако всё большую актуальность приобретает C. auris, часто вызывающая инвазивные инфекции.
Цель работы — сравнение некоторых ферментативных свойств и биоцидной активности C. auris и C. albicans.
Материалы и методы. Исследования проводили на штаммах C. albicans и C. auris. Оценивали рост микромицетов на мясо-пептонном агаре, среде Сабуро или кровяном агаре (с учётом гемолиза). Способность Candida spp. расщеплять белки выявляли на агаре Дифко с 2% казеином и по воздействию на молекулы IgG. Липазную активность кандид определяли на агаре, содержащем Твин-20. Жизнеспособность буккальных эпителиоцитов после воздействия (1–4 ч) метаболитов кандид оценивали с помощью трипанового теста. Статистическую обработку проводили с использованием программы «RStudio».
Результаты. C. albicans лучше всего росли на агаре Сабуро, а C. auris — на кровяном агаре. Гемолитическая и липазная активность была характерна только для C. auris. Наличие протеазной активности было отмечено для некоторых штаммов C. auris: они были способны расщеплять казеин и повреждать структуру молекул IgG. Продукты метаболизма некоторых штаммов кандид снижали жизнеспособность эпителиальных клеток, при этом кратность снижения была более выражена в экспериментах с C. auris (р < 0,05).
Заключение. Наиболее благоприятной средой для культивирования C. auris является кровяной агар. Выраженная протеолитическая, антиглобулиновая, гемолитическая и общая липазная активности были отмечены только у исследуемых штаммов C. auris, что показывает их более высокий инвазивный потенциал по сравнению с C. albicans. Биоцидная активность микромицетов в отношении буккальных эпителиоцитов имела штамм-зависимый характер.
Ключевые слова
Полный текст
Введение
Микроскопические грибы рода Candida — представители факультативной микробиоты человека — могут быть причиной развития оппортунистических микозов [1]. Патогенный потенциал кандид обусловлен наличием у них различных структур и молекул, способствующих адгезии, субэпителиальной инвазии и обеспечивающих противодействие эффекторам иммунитета. Спектр факторов патогенности может зависеть как от вида, так и от штамма кандид, делая отдельных представителей более вирулентными в отношении клеток и тканей человека.
Важную роль в реализации патогенности играют секретируемые факторы Candida spp., обладающие ферментативными и/или токсическими свойствами, такие как кандидализин (цитолитический пептид), фосфолипаза B [2]. Протеиназы микромицетов могут принимать участие в проникновении микромицетов в ткани и уклонении от иммунной системы организма хозяина [3].
Наиболее клинически значимым видом среди кандид считается C. albicans, на долю которого приходится большинство случаев кандидозов различной локализации [4]. Однако всё большую актуальность приобретает эмерджентный патоген — C. auris, отличающийся высокой способностью к инвазии. Сравнение геномов этих двух видов кандид ранее показало, что C. auris обладает способностью адаптироваться к различным условиям окружающей среды и имеет множество факторов патогенности, общих с C. albicans и другими видами Candida [5]. В то же время C. auris-ассоциированные инфекции часто приводят к развитию системных микозов и характеризуются высоким уровнем летальности, особенно у иммунокомпрометированных пациентов и пожилых людей [5].
Целью данного исследования явилось сравнение некоторых ферментативных свойств и биоцидной активности C. auris и C. albicans.
Материалы и методы
Исследования проводили на C. albicans (штаммы 195, 258, 290, 601) и C. auris (штаммы 70, 78, 84, 95) из коллекции кафедры эпидемиологии, микробиологии и доказательной медицины Приволжского исследовательского медицинского университета. Исследуемые штаммы были получены из клинического материала от больных с манифестной формой инфекции в 2021 г., депонировались в коллекцию кафедры и поддерживались путём субкультивирования согласно требованиям СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней».
Для получения метаболитов клетки кандид выращивали в бульоне Сабуро (24 ч, 37ºС). Метаболиты отделяли от клеток при помощи стерильных бактериальных фильтров («Corning»). Для оценки роста колоний производили посев 0,05 мл суспензии кандид с концентрацией 5 × 102 кл/мл на мясо-пептонный агар (МПА), плотную среду Сабуро или кровяной агар. После инкубации (48 ч, 37ºС) производили измерение диаметра выросших колоний.
Для оценки протеазной активности в качестве модельных субстратов, расщепление которых можно было зафиксировать визуально либо спектрофотометрически, были взяты крупные сложные белки, такие как казеин («HiMedia») и иммуноглобулин класса G (IgG) («Микроген НПО»). Данные белки имеют большое разнообразие типов связей между аминокислотами и могут расщепляться различными протеазами. Способность метаболитов Candida spp. расщеплять казеин оценивали путём посева кандид на модифицированный агар Дифко, содержащий 2% соответствующего протеина. После культивирования кандид (48 ч, 37ºС) в чашки наливали 5 мл 5% раствора трихлоруксусной кислоты и наблюдали в течение 3 мин за появлением прозрачных зон гидролиза вокруг колоний Candida spp. [6].
Способность расщеплять молекулы IgG под действием метаболитов кандид оценивали по остаточной антигенсвязывающей активности антител с использованием набора для иммуноферментного анализа (ИФА) для определения интерлейкина-6 («Вектор-Бест») [7]. В лунки планшета с иммобилизованными моноклональными антителами добавляли 200 мкл метаболитов кандид; в качестве контроля использовали стерильный бульон Сабуро. Планшет инкубировали в термостате 1 ч при 37ºС, затем проводили ИФА согласно протоколу производителя («Вектор-Бест») [8].
Общую липазную активность кандид оценивали путём культивирования (48 ч, 37ºС) на агаре, содержащем Твин-20. О продукции кандидами липаз можно судить по образованию матовых ореолов вокруг колоний микромицетов [6].
Гемолитическую активность штаммов Candida spp. оценивали вокруг колоний кандид, выросших (48 ч, 37ºС) на кровяном агаре. Отмечали наличие или отсутствие зоны гемолиза вокруг колоний [6].
Биоцидную активность метаболитов кандид оценивали в отношении буккальных эпителиоцитов (106 кл/мл), которые инкубировали с метаболитами кандид в течение 1–2–3–4 ч при 37ºС. Жизнеспособность эпителиоцитов определяли с помощью трипанового теста, подсчитывая процент живых клеток в суспензии [9].
Статистическую обработку проводили с использованием компьютерной программы «RStudio». Данные каждой выборки проверяли на нормальность распределения и представляли в виде группового среднего арифметического (М) и стандартного отклонения (δ). Межгрупповые различия анализировали с использованием непараметрического критерия Манна–Уитни для малых выборок. Различия считали статистически значимыми при р < 0,05.
Результаты
Оценивали возможность C. auris и C. albicans утилизировать различный набор субстратов, входящих в основу стандартных питательных сред для культивирования микроорганизмов. Культивирование на трех типах питательных сред показало, что для всех штаммов C. albicans наиболее благоприятной средой являлся агар Сабуро (табл. 1): размер колоний был больше, чем на МПА или кровяном агаре, в 1,98 раза. Отметим, что выраженность признака (размер колоний) носила штамм-специфический характер. Штаммы C. auris предпочитали агар Сабуро более, чем МПА, но лучше всего рост наблюдался на кровяном агаре, что проявлялось в увеличении размера выросших колоний по сравнению с микромицетами, выросшими на МПА, в 1,8 и 2,3 раза соответственно (табл. 1).
Таблица 1. Размер колоний штаммов C. albicans и C. auris в зависимости от типа культуральной среды, Μ ± δ / Table 1. Colony size of C. albicans and C. auris strains depending on the type of culture medium, Μ ± δ
Штамм Strain | Размер колоний, мм | Colony size, mm | |||
мясо-пептонный агар nutrient agar | агар Сабуро Sabouraud agar | кровяной агар blood agar | ||
C. albicans | 195 | 1,25 ± 0,38 | 2,75 ± 0,65* | 1,72 ± 0,27 |
258 | 2,38 ± 0,48 | 4,50 ± 0,58* | 1,70 ± 0,27 | |
290 | 1,64 ± 0,47 | 2,30 ± 0,92 | 1,45 ± 0,37 | |
601 | 1,78 ± 0,62 | 4,38 ± 0,48* | 2,17 ± 0,26 | |
C. auris | 70 | 1,50 ± 0,25 | 2,13 ± 0,23* | 3,63 ± 0,74* |
78 | 0,92 ± 0,20 | 2,25 ± 0,27* | 3,80 ± 0,84* | |
84 | 1,25 ± 0,27 | 2,61 ± 0,33* | 2,63 ± 0,33* | |
95 | 1,57 ± 0,35 | 2,50 ± 0,61 | 2,20 ± 0,10 | |
Примечание. *р < 0,05 по сравнению с ростом кандид на МПА.
Note. *p < 0.05 compared with Сandida growth on nutrient agar.
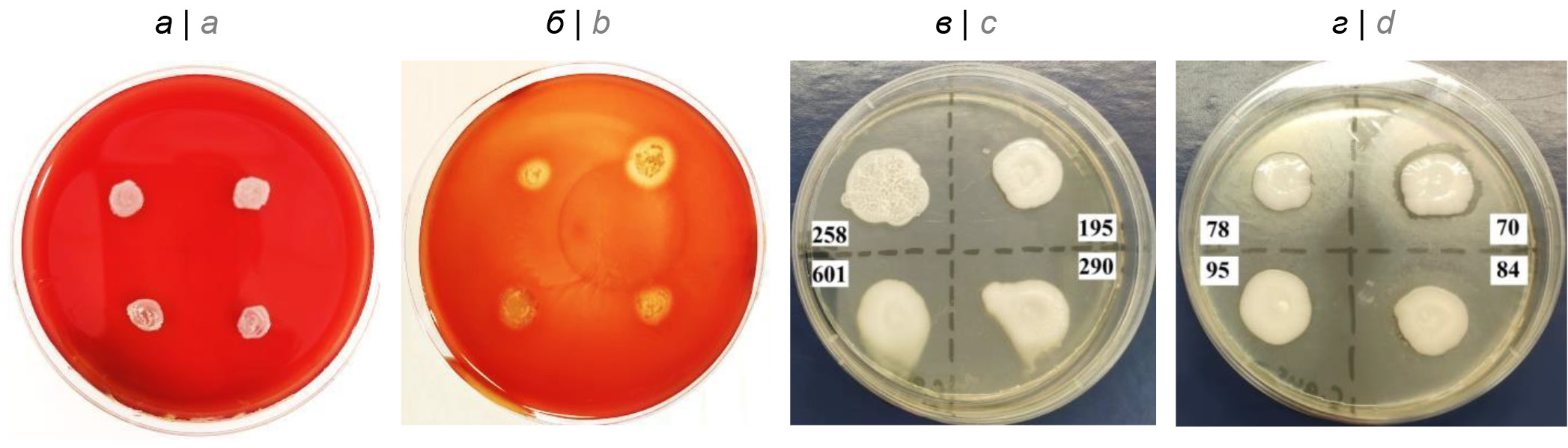
С целью исследования способности извлекать гемоглобин из эритроцитов определяли наличие зон гемолиза вокруг колоний кандид при их культивировании на кровяном агаре. Гемолитическая активность была характерна для всех исследуемых штаммов C. auris и отсутствовала у штаммов C. albicans (рис. 1). Липазная активность была обнаружена у всех исследуемых штаммов C. auris. Она оценивалась визуально и проявлялась наличием широких (2,5–3,0 см в диаметре) матовых ореолов вокруг колоний кандид на агаре, содержащем Твин-20. Подобного свойства не было обнаружено у штаммов C. albicans (рис. 1).
Рис. 1. Гемолитическая (a, б) и липазная (в, г) активность C. albicans и C. auris. a — рост C. albicans на кровяном агаре — гемолиза нет; б — гемолиз вокруг колоний C. auris на кровяном агаре; в — рост C. albicans на агаре, содержащем Твин-20; г — матовые ореолы вокруг колоний C. аuris на агаре, содержащем Твин-20. / Fig. 1. Hemolytic (a, b) and lipase (c, d) activity of C. albicans and C. auris. a — C. albicans growth on blood agar without hemolysis; b — hemolysis around the colonies of C. auris on blood agar; c — C. albicans growth on Тween-20 agar; d — matte halos around the colonies of C. auris on Тween-20 agar.
Протеолитическую активность микромицетов оценивали по их способности расщеплять белки, протеазную активность кандид — по наличию зоны гидролиза в агаре с казеином вокруг колоний. Для штаммов C. auris диаметр зоны гидролиза белка составлял 1–3 мм, в то время как вокруг колоний C. albicans отсутствовали видимые изменения субстрата. Во-вторых, определяли способность расщеплять молекулы IgG человека. Под действием метаболитов некоторых штаммов C. auris (70 и 84), по-видимому, повреждалась структура IgG (со стороны Fab-фрагмента), отвечающая за связывание с антигеном в тест-системе ИФА, что не было отмечено для C. albicans (рис. 2).
Рис. 2. Концентрация функционально активных IgG после часовой экспозиции с метаболитами кандид. *р < 0,05 по сравнению с контролем. / Fig. 2. Сoncentration of functionally active IgG after one-hour exposition with Candida metabolites. *p < 0.05 compared to control.
При оценке биоцидного эффекта кандид на буккальные эпителиоциты человека было установлено, что гибель мукозальных клеток отмечалась уже через 1 ч после их инкубации с метаболитами микромицетов и достигала максимальных значений к 3–4 ч (табл. 2). При этом кратность снижения жизнеспособности эпителиоцитов была более выражена в экспериментах с метаболитами C. auris, чем с C. albicans (р < 0,05). Продукты метаболизма некоторых штаммов C. auris могли снижать жизнеспособность эпителиальных клеток в 3,70 ± 2,51 раза, тогда как метаболиты C. albicans — не более чем в 1,92 ± 0,25 раза (табл. 2).
Таблица 2. Изменение жизнеспособности буккальных эпителиоцитов после инкубации с метаболитами C. auris и C. Albicans / Table 2. Changes of buccal epithelial cells viability after incubation with C. auris and C. albicans metabolites
Штаммы кандид — продуцентов метаболитов Candida strains — producents of metabolites | Кратность снижения количества живых клеток (количество раз) в зависимости от времени инкубации Rates of reduction in number of viable cells (in fold) depending on the incubation time | |||
1 ч | h | 2 ч | h | 3 ч | h | 4 ч | h | |
Контроль | Control | 1,0 | 1,0 | 1,0 | 1,0 |
C. auris 70 | 1,63 ± 0,10* | 1,76 ± 0,12* | 2,18 ± 0,84* | 1,97 ± 0,42* |
C. auris 78 | 1,31 ± 0,19* | 1,64 ± 0,19* | 1,26 ± 0,04* | 1,44 ± 0,01* |
C. auris 84 | 1,42 ± 0,17 | 1,50 ± 0,21 | 2,15 ± 0,33* | 3,70 ± 2,51 |
C. auris 95 | 1,17 ± 0,17 | 1,09 ± 0,09 | 1,61 ± 0,16* | 1,59 ± 0,23* |
C. albicans 195 | 1,19 ± 0,09 | 1,27 ± 0,16 | 1,92 ± 0,25* | 1,86 ± 0,20* |
C. albicans 258 | 1,06 ± 0,08 | 1,13 ± 0,14 | 1,30 ± 0,17 | 1,17 ± 0,24 |
C. albicans 290 | 1,25 ± 0,15* | 1,14 ± 0,18 | 1,41 ± 0,31 | 1,14 ± 0,35 |
C. albicans 601 | 1,24 ± 0,09* | 1,44 ± 0,11* | 1,15 ± 0,22 | 0,60 ± 0,06* |
Примечание. *р < 0,05 по сравнению с контролем — буккальными эпителиоцитами в стерильном бульоне Сабуро.
Note. *p < 0.05 compared to the control — buccal epithelial cells in sterile Sabouraud broth.
Обсуждение
Культивирование кандид на различных вариантах питательных сред показало, что размер колоний всех исследуемых штаммов C. auris на кровяном агаре был статистически значимо больше, чем у C. albicans. Таким образом, для C. auris, в отличие от C. albicans, присутствие гемоглобина в среде служило дополнительным ростовым фактором.
Возникновению и развитию инфекционного процесса способствует наличие у кандид набора факторов патогенности, способствующих адгезии, инвазии и устойчивости к факторам иммунитета. Патогенетический потенциал микроорганизмов зависит, прежде всего, от ферментов и прочих молекул агрессии, приводящих к разрушению различных тканей и клеток хозяина. Наши эксперименты показали более высокую способность к синтезу ферментов и токсинов, обладающих деструктивными свойствами, для всех исследуемых штаммов C. auris по сравнению с C. albicans. Выраженная гемолитическая активность штаммов C. auris свидетельствует о том, что данные микромицеты обладают высокой требовательностью к питательным средам и выраженной способностью к разрушению различных клеток человека, включая эритроциты. Известно, что гемолизины микроорганизмов обычно представлены порообразующими токсинами [10], которые взаимодействуют с мембранами клеток и повреждают их. Так, некоторые авторы [11, 12] связывают высокий уровень (до 60%) смертности при инвазивных инфекциях, вызванных C. auris, с секрецией данных видов гемолизинов.
При исследовании действия метаболитов кандид на буккальные эпителиоциты человека выявлено, что биоцидная активность микромицетов не зависела от вида, а имела штамм-зависимый характер. Таким образом, наличие гемолитической активности, показанное нами для C. auris, не давало им преимущество в преодолении защитного барьера мукозальных клеток. C. auris и C. albicans в равной мере повреждали буккальные эпителиоциты, что, по-видимому, было связано с продукцией иных биоцидных молекул.
Эксперименты также показали, что липазная активность была характерна только для исследуемых штаммов C. auris. Известно, что наличие липазы увеличивает инвазивные возможности микроорганизма, способствуя его проникновению с поверхности кожи в более глубокие слои [11, 12]. Кандиды способны продуцировать различные липазы, в частности, C. albicans синтезируют фосфолипазу В [2, 13]. Тем не менее наши эксперименты показали, что штаммы C. auris обладали более выраженной общей липазной активностью. Это может служить дополнительным объяснением более сильной проникающей способности C. auris по сравнению c C. albicans.
Продукция микроорганизмами протеаз способствует разрушению межклеточных контактов и протеинсодержащих молекул иммунитета. Протеолитическая активность характерна как для C. auris [11], так и для C. albicans [7]. В нашей работе оценена способность кандид гидролизовать высокомолекулярные белки. Данная активность отмечена только у штаммов C. auris. Разрушение в эксперименте сложносоставной белковой молекулы, такой как казеин, может указывать на то, что C. auris способна к расщеплению белковых компонентов межклеточного матрикса. В пользу этого предположения свидетельствуют данные других экспериментов, показывающих, что метаболиты данного микромицета, в отличие от C. albicans, разрушают межклеточные связи в монослое фибробластов человека [9]. Значение подобных экстрацеллюлярных ферментов особенно важно для C. auris в связи с отсутствием гифообразования и возможности пенетрации тканей за счёт гиф [12, 13].
Метаболиты некоторых штаммов C. auris продемонстрировали способность к разрушению молекул IgG. Можно предположить, что наличие такой активности объясняется синтезом кандидами секреторных аспартилпротеиназ. Данные гидролазы отличаются широкой субстратной специфичностью, разрушая многие, в том числе участвующие в иммунном ответе белки: альбумин, коллаген, фибронектин, лактоферрин слюны, интерлейкин-1β и др. [3]. Данное качество C. auris можно рассматривать как один из механизмов антииммунной стратегии, позволяющей данному виду снижать эффективность специфического гуморального звена иммунитета. Антиглобулиновая активность C. auris способствует диссеминации патогена в тканях, а также его стабилизации в циркуляторном русле на стадии кандидемии.
Все вышеуказанное свидетельствует в пользу того, что C. auris хорошо приспособлена к инвазивному типу инфекции.
Заключение
По данным литературы известно, что штаммы C. albicans могут проявлять гемолитическую активность [14]. Однако в наших исследованиях было установлено, что штаммы C. auris чаще проявляют данное качество, при этом демонстрируя более интенсивный рост колоний, чем на среде Сабуро, т.е. являются выраженными гемофильными микромицетами. В связи с этим можно заключить, что наиболее благоприятной средой для культивирования C. auris является кровяной агар, а не среда Сабуро. Эксперименты также показали, что общая протеолитическая и липазная активности были более выражены у штаммов C. auris, что указывало на их более высокий инвазивный потенциал по сравнению с C. albicans. Метаболиты некоторых штаммов C. auris были способны разрушать структуру молекул IgG, что можно рассматривать как дополнительный механизм антииммунной стратегии микромицетов. Биоцидная активность в отношении буккальных эпителиоцитов отмечалась у всех штаммов C. auris и C. albicans, при этом выраженность признака имела штамм-зависимый характер.
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Об авторах
Надежда Ивановна Игнатова
Приволжский исследовательский медицинский университет
Автор, ответственный за переписку.
Email: n.i.evteeva@gmail.com
ORCID iD: 0000-0002-4570-9342
к.б.н., доцент кафедры эпидемиологии, микробиологии и доказательной медицины
Россия, Нижний НовгородМайя Исааковна Заславская
Приволжский исследовательский медицинский университет
Email: n.i.evteeva@gmail.com
ORCID iD: 0000-0003-1895-0699
д.б.н., доцент, профессор кафедры эпидемиологии, микробиологии и доказательной медицины
Россия, Нижний НовгородНаталья Александровна Александрова
Приволжский исследовательский медицинский университет
Email: n.i.evteeva@gmail.com
ORCID iD: 0000-0003-4845-8056
к.б.н., старший преподаватель кафедры эпидемиологии, микробиологии и доказательной медицины
Россия, Нижний НовгородАнна Александровна Лапшина
Приволжский исследовательский медицинский университет
Email: n.i.evteeva@gmail.com
ORCID iD: 0000-0001-9072-9556
магистр кафедры эпидемиологии, микробиологии и доказательной медицины
Россия, Нижний НовгородТатьяна Владимировна Махрова
Приволжский исследовательский медицинский университет
Email: n.i.evteeva@gmail.com
ORCID iD: 0000-0001-6469-8987
к.м.н., доцент, доцент кафедры эпидемиологии, микробиологии и доказательной медицины
Россия, Нижний НовгородОльга Алексеевна Лукова
Приволжский исследовательский медицинский университет
Email: n.i.evteeva@gmail.com
ORCID iD: 0000-0001-7552-9994
к.б.н., старший преподаватель кафедры эпидемиологии, микробиологии и доказательной медицины
Россия, Нижний НовгородСписок литературы
- de Jong A.W., Hagen F. Attack, defend and persist: how the fungal pathogen Candida auris was able to emerge globally in healthcare environments. Mycopathologia. 2019;184(3):353–65. DOI: https://doi.org/10.1007/s11046-019-00351-w
- Mba I.E., Nweze E.I. Mechanism of Candida pathogenesis: revisiting the vital drivers. Eur. J. Clin. Microbiol. Infect. Dis. 2020;39(10):1797–819. DOI: https://doi.org/10.1007/s10096-020-03912-w
- Ilkhanizadeh-Qomi M., Nejatbakhsh S., Jahanshiri Z., Razzaghi-Abyaneh M. Aspartyl proteinase and phospholipase activities of Candida albicans isolated from oropharyngeal candidiasis in head and neck cancer patients. Jundishapur J. Microbiol. 2020;13(9):e105200. DOI: https://doi.org/10.5812/jjm.105200
- Kumamoto C.A., Gresnigt M.S., Hube B. The gut, the bad and the harmless: Candida albicans as a commensal and opportunistic pathogen in the intestine. Curr. Opin. Microbiol. 2020;56:7–15. DOI: https://doi.org/10.1016/j.mib.2020.05.006
- Ahmad S., Alfouzan W. Candida auris: epidemiology, diagnosis, pathogenesis, antifungal susceptibility, and infection control measures to combat the spread of infections in healthcare facilities. Microorganisms. 2021;9(4):807. DOI: https://doi.org/10.3390/microorganisms9040807
- ОФС.1.7.2.0012.15. Производственные пробиотические штаммы и штаммы для контроля пробиотиков. М.; 2015. OFS.1.7.2.0012.15. Production probiotic strains and strains for probiotic control. Moscow; 2015
- Лахтин М.В., Козлов Л.В., Лахтин В.М. и др. Защита потенциальных антител человека от протеолиза секретами клинических штаммов Candida в присутствии пробиотических бактериальных лектинов человека. Астраханский медицинский журнал. 2012;7(1):63–8. Lakhtin M.V., Kozlov L.V., Lakhtin V.M., et al. The protection of the human potential antibodies against proteolysis by the secrets of Candida clinical strains in the presence of the human probiotic bacterial lectins. Astrakhan Medical Journal. 2012;7(1):63–8. DOI: https://doi.org/10.24412/FdxVKV2JAys. EDN: https://elibrary.ru/ozeywz
- Воропаева Е.А., Байракова А.Л., Бичучер А.М. и др. Протеолитическая активность микрофлоры полости рта у больных пародонтитом. Биомедицинская химия. 2008;54(6):706–11. Voropaeva E.A., Bairakova A.L., Bichucher A.M., et al. Proteolytic activity of the oral microflora in patients with periodontitis. Biomedical Chemistry. 2008;54(6):706–11.
- Игнатова Н.И., Заславская М.И., Александрова Н.А. и др. Влияние метаболитов Candida spp. на фибробласты кожи человека. Инфекция и иммунитет. 2022;12(2):381–5. Ignatova N.I., Zaslavskaya M.I., Aleksandrova N.A., et al. Impact of Candida spp. metabolites on human skin fibroblasts. Russian Journal of Infection and Immunity. 2022;12(2):381–5. DOI: https://doi.org/10.15789/2220-7619-IOC-1795. EDN: https://elibrary.ru/plgjav
- Zhang X., Hu X., Rao X. Apoptosis induced by Staphylococcus aureus toxins. Microbiol. Res. 2017;205:19–24. DOI: https://doi.org/10.1016/j.micres.2017.08.006
- Larkin E., Hager C., Chandra J., et al. The emerging pathogen Candida auris: growth phenotype, virulence factors, activity of antifungals, and effect of SCY-078, a novel glucan synthesis inhibitor, on growth morphology and biofilm formation. Antimicrob. Agents Chemother. 2017;61(5):e02396-16. DOI: https://doi.org/10.1128/aac.02396-16
- Ahmad Khan M.S., Alshehrei F., Al-Ghamdi S.B., et al. Virulence and biofilms as promising targets in developing pathogenic drugs against candidiasis. Future Sci. OA. 2020;6(2):FSO440. DOI: https://doi.org/10.2144/fsoa-2019-0027
- Rossato L., Colombo A.L. Candida auris: what have we learned about its mechanisms of pathogenicity? Front. Microbiol. 2018;9:3081. DOI: https://doi.org/10.3389/fmicb.2018.03081
- Rossoni R.D., Barbosa J.O., Vilela S.F., et al. Comparison of the hemolytic activity between C. albicans and non-albicans Candida species. Braz. Oral Res. 2013;27(6):484–9. DOI: https://doi.org/10.1590/s1806-83242013000600007
Дополнительные файлы