Механизмы формирования толерантности Toll-подобных рецепторов под действием микробных лигандов
- Авторы: Булгакова И.Д.1,2, Свитич О.А.1,2, Зверев В.В.1,2
-
Учреждения:
- Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
- Первый Московский государственный медицинский университет им. И.М. Сеченова
- Выпуск: Том 99, № 6 (2022)
- Страницы: 708-721
- Раздел: ОБЗОРЫ
- URL: https://microbiol.crie.ru/jour/article/view/1272
- DOI: https://doi.org/10.36233/0372-9311-323
- ID: 1272
Цитировать
Аннотация
Некоторые микроорганизмы способны формировать толерантность. С одной стороны, это позволяет патогенным микробам ускользать от иммунного надзора, с другой стороны — даёт возможность представителям микробиоты колонизировать различные биотопы и выстраивать симбиотические отношения с макроорганизмом. Сложные регуляторные взаимодействия врождённого и адаптивного иммунитета, а также стимуляция антигенами позволяют микробам управлять состоянием иммунологической толерантности. Важную роль в этом процессе играют клетки врождённого иммунитета, которые распознают компоненты микробов при помощи паттерн-распознающих рецепторов. Основным классом этих рецепторов являются Toll-подобные рецепторы (TLRs). При этом, несмотря на универсальность активируемых сигнальных путей, можно наблюдать различные клеточные ответы при взаимодействии TLRs с представителями микробиоты и патогенными микробами, они также будут различаться при острой и хронической инфекции. Изучение механизмов формирования толерантности TLRs имеет большую ценность, поскольку эти рецепторы вовлечены в широкий спектр инфекционных и неинфекционных заболеваний, а также играют важную роль в развитии аллергических, аутоиммунных патологий и онкологических заболеваний. Понимание механизмов формирования толерантности TLRs может также внести существенный вклад в разработку препаратов на основе лигандов этих рецепторов для лечения и профилактики многих заболеваний.
Полный текст
Введение
Иммунологическая толерантность — это состояние, при котором не происходит активации лимфоцитов в присутствии определённого антигена. В соответствии с клонально-селекционной теорией Ф.М. Бернета, рецепторы лимфоцитов, распознающие антигены, распределены в популяции клонально, а реакция на связывание антигена зависит от степени зрелости этих лимфоцитов. Таким образом формируется толерантность к антигенам, попадающим в организм до наступления иммунологической зрелости [1–3]. Представители микробиоты начинают колонизировать организм новорождённого и образовывать уникальные микробные сообщества как раз в тот момент, когда созревание иммунной системы ещё не завершено [4]. Метаболиты и компоненты клеток представителей микробиоты, попадая в кровоток, меняют функциональную настройку иммунной системы хозяина, в том числе регулируют чувствительность рецепторов врождённого иммунитета, к которым относятся Toll-подобные рецепторы (TLRs) [5].
Известны попытки объяснить механизмы изменения чувствительности этих рецепторов в рамках рецепторной, рецепторно-сигнальной и эпигенетической теорий [6], однако концепция, которая могла бы объединить все данные, полученные при исследовании толерантности TLRs, не сложилась. Более детальное изучение различных типов TLRs, их лигандов, активируемых внутриклеточных сигнальных путей, анализ генов, а также особенностей эпигенетической регуляции позволят раскрыть механизмы формирования толерантности TLRs.
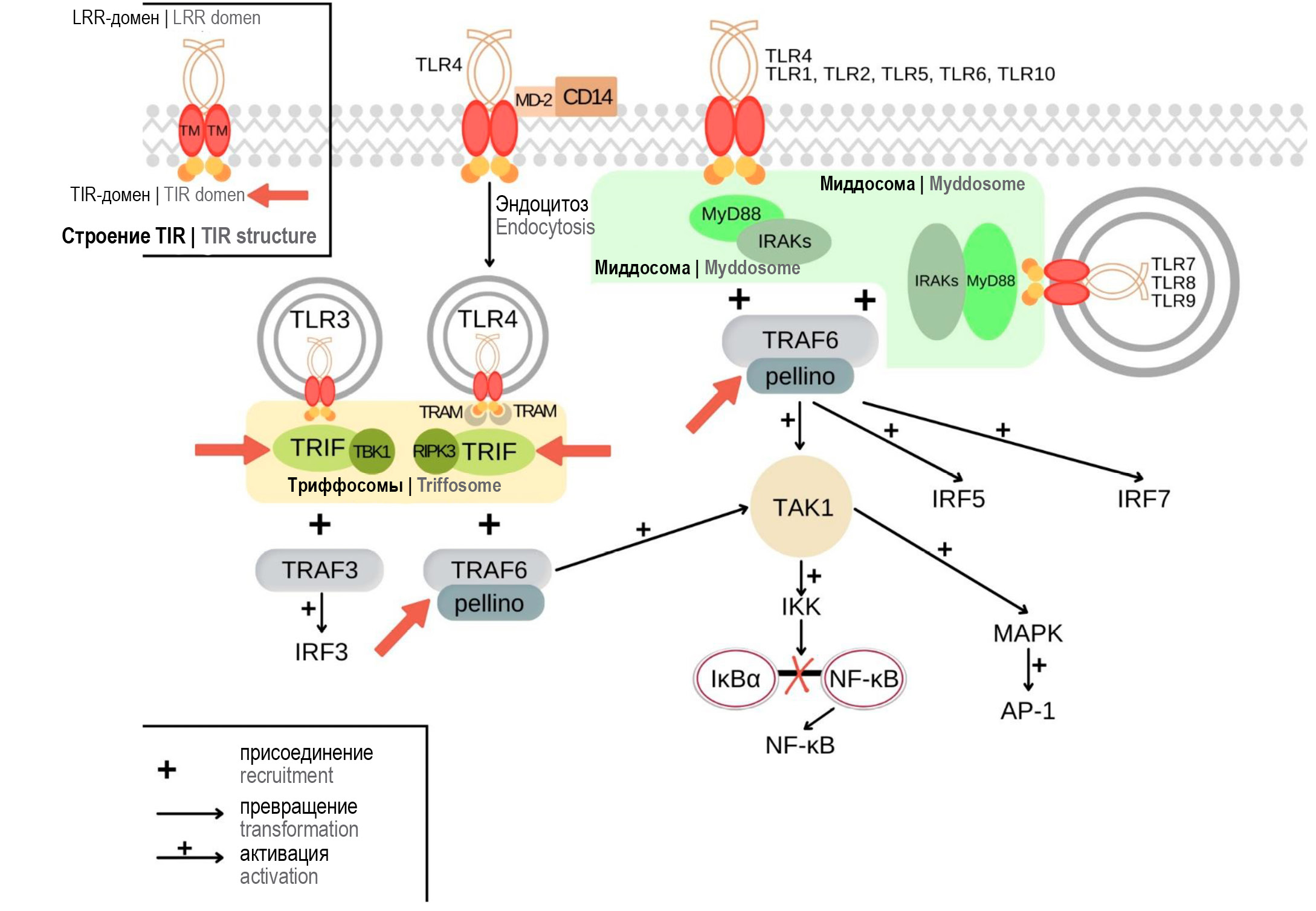
TLRs — это рецепторы врождённого иммунитета, способные распознавать PAMPs (патоген-ассоциированные молекулярные структуры) и DAMPs (молекулярные фрагменты, ассоциированные с повреждениями). У человека выделены 10 типов TLRs: TLR1, TLR2, TLR4, TLR5, TLR6, TLR10 относятся к рецепторам цитоплазматической мембраны, а TLR3, TLR7, TLR8 и TLR9 располагаются на эндолизосомальной мембране [7, 8]. После связывания лиганда TLRs образуют гомо- или гетеродимеры, происходит рекрутирование компонентов сигнальных путей, которые включают в себя адаптерные белки, киназы и факторы транскрипции. Схема сигнальных путей TLRs представлена на рис. 1 [7, 9, 10]. Каждый сигнальный путь связан с образованием надмолекулярного организующего центра (supramolecular organizing centre — SMOC). Все TLRs, кроме TLR3, участвуют в активации MyD88-зависимого пути, в котором SMOC представлен миддосомой, в основе которой лежит цитозольный адаптерный белок MyD88. Вовлечение этого сигнального пути приводит к активации факторов транскрипции АР-1, NF-κB, IRF5, в результате чего индуцируется экспрессия антимикробных факторов и медиаторов воспаления, а также осуществляется регуляция апоптоза [7, 11]. Через рецепторы TLR3 и TLR4 реализуются эффекты MyD88-независимого сигнального пути, центральным звеном которого является белок TRIF, который участвует в образовании другого SMOC — триффосомы. В результате вовлечения этого пути происходит активация транскрипционного фактора IRF3, ответственного за экспрессию интерферонов I типа. Кроме того, существуют и другие эффекты, связанные TLRs, которые присутствуют у неиммунных клеток [7, 11, 12].
Рис. 1. Сигнальные пути TLRs, сборка миддосомы и триффосомы. Красными стрелками указаны возможные механизмы формирования толерантности на уровне образования SMOCs. / Fig. 1. TLR signaling pathways, myddosome and triffosome assembly. Red arrows show the possible mechanisms underlying tolerance development at the SMOC level.
Исходя из вышеописанного, можно сделать вывод, что TLRs являются полифункциональными и существуют определённые механизмы, позволяющие «переключать» клеточные ответы в различных условиях. При этом, за некоторым исключением, тип лиганда значения не имеет. Среди лигандов TLRs есть экзогенные и эндогенные вещества. Экзогенные лиганды (PAMPs) представлены липополисахаридом (ЛПС), пептидогликаном, тейхоевыми и липотейхоевыми кислотами, флагеллином, зимозаном, ДНК и РНК вирусов, аналогами нуклеозидов и др. Некоторые типы рецепторов преимущественно чувствительны к компонентам определённых микробов: грамположительных (TLR1, TLR2, TLR6) и грамотрицательных (TLR4, TLR5) бактерий, вирусов (TLR3, TLR7, TLR8, TLR9), простейших и грибов (TLR1, TLR2, TLR6). В качестве эндогенных лигандов могут выступать различные DAMPs, например, белки теплового шока (Hsp60, Hsp70, Hsp96), дефензины, фибриноген [13, 14].
Несмотря на огромный спектр лигандов, до сих пор точно не известно, почему в одних случаях возникает ответ на стимуляцию TLRs, а в других нет, какие механизмы регулируют эти процессы, играет ли роль природа лиганда, его количество, частота стимуляции TLRs, тип клеток и т.д. Попробовать ответить на эти вопросы можно, изучив более подробно такое явление, как толерантность TLRs.
Толерантность TLRs
Толерантность TLRs — это отсутствие или снижение эффектов от стимуляции TLRs. Ранние исследования на моделях in vivo привели к ошибочному предположению, что лихорадка может являться показателем чувствительности TLRs к эндотоксинам, в связи с чем механизм развития толерантности TLRs рассматривался как десенсибилизация этих рецепторов. С открытием конкретных механизмов передачи внутриклеточных сигналов вследствие лигирования TLRs стало очевидно, что толерантность развивается не из-за десенсибилизации рецепторов, а благодаря изменённой реакции на стимуляцию. Впервые это было продемонстрировано на примере TLR4, а в качестве лиганда использовали эндотоксин [15]. Наблюдаемый феномен обозначили термином «ЛПС-индуцированная толерантность», однако это не единственный лиганд, способный формировать состояние толерантности TLRs, поэтому далее в статье будет использован термин «индуцированная толерантность». Регуляция по принципу обратной отрицательной связи обеспечивает снижение выброса провоспалительных цитокинов, что необходимо для того, чтобы длительное или повторное воздействие лигандов TLRs не приводило к неконтролируемому или несоответствующему воспалению с последующим повреждением тканей [15, 16].
Таким образом, произошло расширение рецепторной теории толерантности TLRs до рецепторно-сигнальной. Однако со временем были обнаружены специфические для генов регуляторные механизмы, позволяющие модифицировать TLR-индуцированный клеточный ответ. В эксперименте длительное воздействие ЛПС приводило к различным изменениям хроматина, в связи с чем были выделены два класса генов: толеризуемые и нетолеризуемые. Это открытие дало начало новой теории формирования толерантности TLRs — эпигенетической [15]. Таким образом, индуцированная толерантность TLRs представляет собой глобальный сдвиг транскрипции от провоспалительного к противовоспалительному ответу при сохранении защитной функции врождённого иммунитета в контексте хронической или продолжающейся инфекции, но этот процесс не универсален и избирателен из-за большого разнообразия паттернов экспрессии цитокинов. Схема индуцированной толерантности TLRs представлена на рис. 2.
Рис. 2. Упрощённая схема формирования индуцированной и перекрестной толерантности TLRs. / Fig. 2. Simplified schematic diagram of induced and cross TLR tolerance.
Закономерность заключается лишь в том, что, чем сильнее изначальная активация генов, тем эффективнее индуцированная толерантность [15–17]. При этом предполагается, что ответ клетки на стимуляцию TLRs реализуется по принципу «все или ничего», однако пороговое значение сигнала, необходимое для вовлечения компонентов сигнальных путей, является величиной непостоянной и регулируется SMOCs [7, 11, 18]. Например, анализ отдельных клеток после стимуляции TLRs различными дозами PAMPs продемонстрировал, что скорость индуцированной транслокации NF-κB в ядро не зависит от количества лиганда. Увеличение дозы лишь изменяет процент клеток, которые допускают транслокацию NF-κB [19].
Стоит отметить, что толерантность TLRs является обратимой. Модификация хроматина в толеризованных генах позволяет сохранить изменённую реакцию на повторную стимуляцию клеток, но эти изменения обратимы со временем или в ответ на конкурирующие сигналы [15, 20]. Примером обратимости индуцированной толерантности являются исследования in vivo макрофагов мышей, толеризованных ЛПС. После обработки гранулоцитарно-макрофагальным колониестимулирующим фактором или интерфероном-γ с последующей инъекцией второй дозы ЛПС у таких мышей наблюдалось частичное восстановление фактора некроза опухоли-α (ФНО-α) и интерейкина (ИЛ) 10, но не до уровня контрольной группы [21].
При изучении компонентов сигнальных путей, связанных с разными TLRs, было открыто такое явление, как перекрёстная толерантность — феномен, при котором предварительное воздействие одного лиганда TLR индуцирует толерантность к воздействию лигандами на другие типы TLRs. При этом реализация этого вида толерантности возможна только между рецепторами, активация которых приводит к вовлечению одних и тех же начальных компонентов сигнальных путей [6, 22–24]. Схема формирования перекрестной толерантности TLRs представлена на рис. 2.
В случае, если лигирование TLRs приводит к вовлечению разных адаптерных белков, но при этом в конечном итоге активируются одни и те же факторы транскрипции, можно наблюдать эффект, противоположный толерантности, — прайминг, т.е. усиление клеточного ответа. Такой феномен согласуется с идеей, что SMOCs могут регулировать пороговое значение сигнала [6, 23, 24].
Перекрёстная толерантность не обязательно бывает такой же эффективной, как толерантность, вызванная повторным воздействием на один тип TLRs, т.е. аутотолерантность. Например, клетки, обработанные сначала активируемым макрофагами липопептидом 2 — лигандом TLR2 (MALP-2), не отвечают на последующую стимуляцию ЛПС (лигандом TLR4), а клетки, предварительно обработанные ЛПС, не отвечают на стимуляцию липотейхоевой кислотой (лигандом TLR2) или флагеллином (лигандом TLR5). Однако предварительная обработка клеток липотейхоевой кислотой, ЛПС и CpG (лигандом TLR9) приводила к индуцированной аутотолерантности каждого TLRs к этим лигандам, но перекрестную толерантность индуцировали именно липотейхоевая кислота и ЛПС, но не CpG. Эти данные указывают на то, что перекрёстная толерантность TLRs реализуется посредством разных механизмов [23].
Такой избирательный характер перекрёстной толерантности позволяет сохранить адекватный иммунный ответ на определённые патогены, особенно это имеет значение в контексте противовирусного иммунного ответа. Например, синтез ФНО-α ингибируется в макрофагах, толерантных ко всем тестируемым лигандам TLRs, однако синтез других цитокинов, таких как ИЛ-6, ингибируется в клетках, толерантных за счёт лигирования TLR4 и TLR3, а синтез интерферона-β1 — в клетках, толеризуемых лигандами TLR4 и TLR2. Отсутствие репрессии генов, отвечающих за синтез интерферона-β1 в клетках, толеризуемых лигандом TLR3, может отражать важность интерферонов в противовирусном иммунном ответе. Точно так же синтез хемокинов CXCL9 и CXCL10 макрофагами с толеризованными TLR3 коррелирует с ролью этих факторов в привлечении CD8+-Т-клеток к участкам вирусной инфекции. Повторная стимуляция TLR9 или TLR2 толерантных клеток индуцирует экспрессию генов ИЛ-10 на уровнях, сравнимых со стимуляцией наивных макрофагов, а предварительная обработка клеток лигандами TLR4 и TLR3 приводит к снижению синтеза ИЛ-10 [16].
Ранее уже упоминалось, что основными теориями формирования толерантности TLRs являются рецепторно-сигнальная и эпигенетическая. Однако, в связи с большим объёмом новой информации о механизмах формирования толерантности TLRs, этот феномен уже не укладывается в рамки одной концепции, поэтому далее будут рассмотрены отдельные конкретные механизмы, о которых известно на сегодняшний день.
Регуляторные механизмы формирования толерантности TLRs на этапе доставки лиганда к рецептору
Для взаимодействия лиганда с некоторыми TLRs необходимы дополнительные компоненты. Соответственно, развитию толерантности способствует как дефицит этих компонентов, так и их избыток. При этом механизмы формирования толерантности будут различными. В первом случае активация компонентов сигнальных путей не происходит из-за нарушения образования рецепторного комплекса, во втором развивается индуцированная толерантность. Как было описано ранее, индуцированная толерантность TLRs напрямую связана с предшествующей активацией этих рецепторов и супериндуцированным состоянием генов [15–17]. Внеклеточный ЛПС-связывающий белок образует прямые контакты с бактериями и изменяет наружную мембрану таким образом, чтобы облегчить экстракцию ЛПС. ЛПС-связывающий белок переносит ЛПС на заякоренный и связанный с TLR4 корецептор CD14. В активации TLR4 также участвуют молекулы MD-2. Таким образом, активный рецепторный комплекс состоит из ЛПС, TLR4, CD14 и MD-2, где CD14 усиливает эндоцитоз TLR4 [25–28]. В эксперименте с ИЛ-27, который стимулирует экспрессию TLR4 и продукцию растворимого CD14, было показано, что ИЛ-27 предотвращает развитие толерантности к ЛПС. Однако выявлено также, что повышенная базальная экспрессия связанного с мембраной CD14 может способствовать CD14-опосредованному эндоцитозу и отвечать за сохранение толерантности к ЛПС в присутствии ИЛ-27. Схема описанного эксперимента представлена на рис. 3 [29].
Рис. 3. ИЛ-27 повышает экспрессию растворимого CD14 (sCD14), что приводит к полному восстановлению чувствительности TLR4 к ЛПС на клетках с низким уровнем экспрессии мембранного CD14 (слева), вследствие чего наблюдается повышение синтеза ФНО-α. Клетки с высоким уровнем экспрессии мембранного CD14 (справа) сохраняют состояние ЛПС-индуцированной толерантности, несмотря на присутствие ИЛ-27, что проявляется низким уровнем продукции ФНО-α. / Fig. 3. IL-27 enhances the expression of soluble CD14 (sCD14), resulting in the completely recovered TLR4 sensitivity to LPS in the cells with a low expression level of membrane CD14 (on the left) and causing the increased production of TNF-α. The cells with high levels of membrane CD14 expression (on the right) retain a state of LPS-induced tolerance, despite the presence of IL-27, which is manifested in low production levels of TNF-α.
Ещё одним примером является особенность эпителия кишечника. Эти клетки имеют апикальную, базальную и латеральную поверхности и экспрессируют TLRs. В то время как базолатеральная стимуляция TLR9 мобилизует воспалительный каскад, апикальная стимуляция TLR9 доставляет отрицательные сигналы, которые ограничивают воспалительные реакции на последующую базолатеральную стимуляцию TLRs (рис. 4). С одной стороны, это способствует поддержанию гомеостаза, а с другой — может являться одним из механизмов толерантности TLRs к представителям микробиоты кишечника [30, 31].
Рис. 4. Механизм подавления базолатеральной стимуляции TLR9 апикальной передачей сигналов TLR9. / Fig. 4. Mechanism of suppression of basolateral TLR9 stimulation by apical delivery of TLR9 signals.
Регуляторные механизмы формирования толерантности TLRs на этапе взаимодействия лиганда с рецептором
К данным механизмам можно отнести взаимодействие TLRs с антагонистами и нарушение образования рецепторного комплекса. Здесь имеет значение не только тип рецептора, но и природа лиганда. Особое значение этот механизм регуляции имеет для TLR4. Во-первых, этот рецептор участвует как в MyD88-зависимом, так и в MyD88-независимом пути передачи, что означает различные конечные эффекты в результате их активации. Во-вторых, как указывалось выше, для активации MyD88-независимого пути через TLR4 необходимы также молекулы MD-2 и корецептор CD14 [32, 33]. Существуют микробные антагонисты TLR4, которые способны избирательно блокировать активацию поверхностного TLR4 благодаря длинным алифатическим цепям жирных кислот, которые попадают в полость связывания MD-2. К таким лигандам относятся ЛПС фотосинтезирующих бактерий Rhodobacter sphaeroides, обитающих на дне озёр, а также ЛПС цианобактерий. После введения этих антагонистов TLR4 или их синтетических аналогов последующее лигирование TLR4 ЛПС от Escherichia coli O111:B4 не приводило к активации внутриклеточных сигнальных путей. Таким образом, подобные антагонисты TLR4 уменьшают димеризацию комплексов TLR4–MD-2–агонист, тем самым предотвращая активацию TLR4, а также ингибируют нижестоящие внутриклеточные сигнальные пути [34].
Подобный механизм формирования толерантности существует и для TLR2. Стафилококковый суперантигенподобный протеин 3 (SSL3) окружает карман для связывания липопептидов на эктодомене TLR2, предотвращая доступ агонистов к полости рецептора, а также нарушает рекрутирование нижестоящего адаптерного белка благодаря ограничению конформационных изменений, возникающих уже после взаимодействия TLR2 с липопептидом [35].
В качестве ещё одного примера можно привести несколько исследований, раскрывающих механизмы формирования толерантности к представителям микробиоты. Комменсальные бактерии часто имеют изменённую структуру ЛПС, в связи с чем он хуже распознаётся TLRs. Некоторые виды Bacteroides обычно содержат структуры пентаацилированного и монофосфорилированного липида А в качестве доминирующего компонента ЛПС. Эти структуры слабо активируют TLR4-зависимые воспалительные реакции. В соответствии с идеей, что минимизация передачи сигналов TLR4 является важным аспектом комменсализма, подавляющее большинство представителей Bacteroides, присутствующих в кишечнике человека, кодирует фермент LpxF, который отвечает за образование монофосфорилированного липида A [36, 37].
При изучении рассеянного склероза обнаружено, что концентрация L654 (лиганда TLR2), источником которого являются представители микробиоты, значительно понижена в крови у таких пациентов. В ходе дальнейшего изучения этого явления было выдвинуто предположение, что продукты, полученные от микробиоты, такие как L654, способны попадать в системный кровоток и вызывать состояние относительной толерантности TLRs. Таким образом, когда циркулирующие уровни компонентов микробиоты недостаточны, нормальная индукция толерантности TLRs может быть недостаточной, что приводит к более низкому порогу активации TLR2, в связи с чем большее количество клеток будет продуцировать провоспалительные цитокины. Это может способствовать развитию аутовоспалительных заболеваний, таких как рассеянный склероз [38, 39].
Регуляторные механизмы формирования толерантности TLRs на этапе образования SMOCs
События, происходящие в клетке после лигирования TLRs, видимо, гораздо сложнее, чем представлялось изначально. Каждый сигнальный путь связан с образованием SMOC. Предполагается, что эти структуры могут способствовать амплификации сигнала для достижения порогового значения и определять специфичность клеточных ответов. В передаче сигналов от TLRs участвуют две разновидности SMOCs — миддосома (основным компонентом которой является белок MyD88) и триффосома (структура, центральным звеном которой является белок TRIF) [7, 10, 11, 17, 40].
Сборка миддосом вследствие активации TLR2, TLR4 и TLR9 происходит с участием адаптерного белка MAL, который обеспечивает взаимодействие с белком MyD88, в результате чего происходит рекрутирование в миддосому киназ семейства IRAK, а затем и TRAF6. Передача сигнала по MyD88-зависимому пути через остальные TLRs и сборка миддосом происходят аналогичным образом, но без участия адаптерного белка MAL, хотя внутриклеточные события, происходящие после лигирования некоторых рецепторов, ещё изучены недостаточно [7, 9, 11].
Триффосома образуется после активации TLR3, что рекрутирует адаптерный белок TRIF, а затем присоединяется убиквитинлигаза TRAF3 и активируется киназа TBK1 [9, 11, 34]. Активация TLR4 не всегда приводит к образованию триффосомы. По всей видимости, для реализации этого пути необходим эндоцитоз TLR4. Вероятно, этот процесс обеспечивает активный рецепторный комплекс, который состоит из TLR4, CD14 и MD-2, где CD14 как раз обеспечивает эндоцитоз TLR4. Адаптерный белок TRAM взаимодействует с TRIF, что приводит к рекрутированию в триффосому TRAF6 [7, 9, 11, 27–29, 34].
Некоторые патогенные микробы используют факторы вирулентности на основе белков, чтобы нарушать активацию внутриклеточных сигнальных путей, воздействуя на компоненты SMOCs. Нижеописанные мишени обозначены на рис. 1. Например, всё большее количество бактерий и вирусов кодируют белки, содержащие TIR-домен, которые непродуктивным образом взаимодействуют с компонентами миддосомы. Механизмы, лежащие в основе этих непродуктивных взаимодействий, чётко не определены, но мутантные штаммы, у которых отсутствуют белки, содержащие TIR-домен, вызывают сильные воспалительные реакции и являются авирулентными [41–43].
Дополнительная стратегия, используемая патогенными микробами для подавления передачи сигналов TLRs, заключается в кодировании протеаз. В качестве примера можно привести вирусы гепатита С и Коксаки, которые кодируют протеазы, расщепляющие TRIF, что приводит к ингибированию передачи сигнала от TLR3 [7].
Поскольку разные TLRs задействуют разные комбинации адаптерных молекул, ответ на специфические агонисты TLRs отражает комбинацию ферментов и субстратов, которые рекрутируются на специфический рецептор/адаптерный комплекс. Некоторые патогенные бактерии и вирусы способны воздействовать сразу на несколько субстратов, в связи с чем сложно выделить отдельные эффекты и отследить их роль в формировании толерантности TLRs [7].
Для более детального изучения таких механизмов больше подходят модели с нокаутом определённых генов. Что касается триффосомы, в качестве примера можно привести мышей с нокаутом TRIF. Этот дефект проявляется нарушением индукции интерферона-β и активации IRF-3 в ответ на агонисты TLR3 и TLR4. Примером формирования индуцированной толерантности на уровне миддосомы являются белки, действующие как убиквитинлигаза (TRAF6), и непосредственно убиквитинлигазы E3 pellino-1 и -2, которые способны перекрывать активность TRAF6. Клетки, лишённые всех трёх этих ферментов, дефектны в плане синтеза ИЛ-1. Клетки, лишённые только TRAF6, не являются дефектными для этих ответов. Кроме того, мутанты TRAF6, лишённые ферментативной активности, сохраняют способность опосредовать быстрые транскрипционные ответы, управляемые миддосомами, но эти ответы не могут быть устойчивыми [44, 45].
Таким образом, конкретные механизмы формирования толерантности на этапе образования SMOCs изучены недостаточно, но миддосомы и триффосомы могут быть потенциальными мишенями в развитии индуцированной толерантности с целью ухода патогенных микробов от иммунного ответа.
Регуляторные механизмы формирования толерантности TLRs за счёт воздействия на факторы транскрипции и репрессии генов
Многие исследования подтверждают важность NF-κB в индукции воспалительных генов. Толерантность TLRs преимущественно обусловлена ауторегуляцией NF-κB, при этом тип лиганда значения не имеет. Гены, репрессированные во время толерантности, в значительной степени связаны с NF-κB-зависимой транскрипцией, в то время как мотивы IRF и B-ZIP избыточно представлены в промоторах генов, которые супериндуцированы в толерантных клетках. Вероятно, в этом и заключается ключевая роль фактора транскрипции NF-κB в качестве активатора провоспалительных генов всех TLRs и индукции их толерантности [15, 17, 46, 47]. Например, белки вируса гепатита С способны подавлять ядерную транслокацию NF-kB в дендритных клетках [48]. Индуцировать толерантность также возможно путём воздействия и на другие факторы транскрипции [7, 49].
Как уже упоминалось ранее, при развитии индуцированной толерантности уровень цитокинов и хемокинов снижался неоднородно, даже если уровень экспрессии их генов контролировался одними внутриклеточными механизмами. В связи с этим было выдвинуто предположение, что только часть генов способна репрессироваться в результате индуцированной толерантности TLRs. В пользу данной концепции свидетельствуют данные транскриптомного анализа, полученные после взаимодействия TLR4 с классическим лигандом — ЛПС. Обнаружены два класса генов: толеризуемые гены, которые репрессировались в процессе лигирования, и нетолеризуемые гены, которые не репрессировались [15, 50, 51]. Функциональная классификация ЛПС-индуцибельных генов показала, что провоспалительные факторы относятся преимущественно к классу толеризуемых генов, в то время как гены, кодирующие антимикробные факторы, включая антимикробные пептиды и рецепторы-мусорщики, попадают в класс нетолеризуемых [15].
Регуляторные механизмы формирования толерантности TLRs за счёт некодирующих РНК и модификации гистонов
В недавних исследованиях было выявлено, что некодирующие РНК (ncRNAs), такие как малые некодирующие молекулы РНК (miRs) и длинные некодирующие РНК (lncRNAs), могут модулировать иммунный ответ. Многие miRs активируются или ингибируются после взаимодействия TLRs с некоторыми лигандами. Эти miRs участвуют в регуляции сигнальных путей, воздействуя на MyD88, TRIF, IRAKs и TRAF6, а также на IRF3, NF-kB и AP-1 [52]. Кроме того, секретируемые miRs способны проникать в микробные клетки, что, в свою очередь, может приводить к изменениям состава микробиоты и иммунологической толерантности [53]. Известно, что экспрессия lncRNA повышается или понижается после взаимодействия лигандов с TLRs. Гены, кодирующие lncRNA, часто входят в число наиболее динамически регулируемых генов в TLR-активированных клетках и затем выступают в качестве положительных или отрицательных регуляторов этой активации [54].
Регуляторные механизмы формирования толерантности TLRs за счёт модификации гистонов также вызывают изменения в экспрессии генов во время толерантности к ЛПС [55, 56]. Исследования отдельных ЛПС-чувствительных генов предполагают, что промоторы генов также динамически регулируются, что приводит к толерантности. Например, триметилирование гистона H3K4, связанное с транскрипцией, индуцируется на промоторах в ответ на стимуляцию ЛПС. Однако во время толерантности триметилирование H3K4 больше не активируется на промоторах толеризуемых генов, например генов, отвечающих за синтез ИЛ-6, а скорее, индуцируется только на промоторах нетолеризуемых генов. Обработка паргилином, ингибитором H3K4-деметилазы, способна снова приводить к метилированию H3K4 на промоторе гена ИЛ-6 и снизить супрессию ИЛ-6 во время толерантности [55].
«Тренированный» врождённый иммунитет и индуцированная толерантность TLRs
Как было указано выше, индуцированная толерантность может быть обратимой, однако некоторые клетки способны сохранять «память», что наводит на мысль о том, что процессы формирования индуцированной толерантности могут иметь сходства с феноменом «тренированного» врождённого иммунитета. Косвенно об этом свидетельствуют данные, полученные при исследовании транскриптомных профилей макрофагов, вышедших из толерантного состояния. Они принимали гибридное состояние, т.е. сохраняли особенности M1 и M2 [7, 57–59].
Общность между механизмами толерантности и тренированным врождённым иммунитетом состоит в том, что оба, по-видимому, регулируются на уровне генов цитокинов, что косвенно подтверждается заметными модификациями гистонов. Однако остаётся неясным, как эти два феномена, отвечающие, по сути, за противоположные эффекты, связаны друг с другом, какие конкретные внутриклеточные события ассоциированы с тренированным врождённым иммунитетом, а какие — с индуцированной толерантностью. Причины, условия, метаболические изменения клетки, а также механизмы регуляции этих процессов нуждаются в дальнейшем изучении [15].
Заключение
В последние годы расширилось представление о молекулярных механизмах, связанных с сигнальными путями TLRs, тем не менее исследование этих рецепторов до сих пор является новой областью с большим потенциалом для клинического применения. На сегодняшний день достаточно большое количество препаратов, мишенью которых являются TLRs или нижестоящие компоненты сигнальных путей, проходят различные этапы клинических испытаний [38, 60–63].
Однако механизмы индуцированной и перекрёстной толерантности, а также феномен тренированного врождённого иммунитета ещё изучены недостаточно, чтобы быть уверенными в отсутствии нежелательных эффектов, которые могут проявиться со временем или при определённых условиях. Современные исследования толерантности TLRs освещают лишь отдельные фрагменты её регуляции. Для формирования более целостного представления сути данного процесса необходимы дальнейшие исследования.
Об авторах
Ирина Дмитриевна Булгакова
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова; Первый Московский государственный медицинский университет им. И.М. Сеченова
Автор, ответственный за переписку.
Email: bulgakova_i_d@staff.sechenov.ru
ORCID iD: 0000-0002-2629-9616
м.н.с. лаб. молекулярной иммунологии, аспирант и ассистент каф. микробиологии, вирусологии и иммунологии
Россия, Москва; МоскваОксана Анатольевна Свитич
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова; Первый Московский государственный медицинский университет им. И.М. Сеченова
Email: svitich_o_a@staff.sechenov.ru
ORCID iD: 0000-0003-1757-8389
д.м.н., член-корр. РАН, зав. лаб. молекулярной иммунологии, директор, проф. каф. микробиологии, вирусологии и иммунологии
Россия, Москва; МоскваВиталий Васильевич Зверев
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова; Первый Московский государственный медицинский университет им. И.М. Сеченова
Email: zverev_v_v@staff.sechenov.ru
ORCID iD: 0000-0002-0017-1892
д.б.н., акад. РАН, науч. рук., проф., зав. каф. микробиологии, вирусологии и иммунологии
Россия, Москва; МоскваСписок литературы
- Козлов В.А. Иммунная парадигма и иммуносупрессорная доминанта в патогенезе основных заболеваний современного человека. Бюллетень Сибирской медицины. 2019; 18(1): 7–17. https://doi.org/10.20538/1682-0363-2019-1-7-17
- Burnett D.L., Reed J.H., Christ D., Goodnow C.C. Clonal redemption and clonal anergy as mechanisms to balance B cell tolerance and immunity. Immunol. Rev. 2019; 292(1): 61–75. https://doi.org/10.1111/imr.12808
- Hodgkin P.D. Modifying clonal selection theory with a probabilistic cell. Immunol. Rev. 2018; 285(1): 249–62. https://doi.org/10.1111/imr.12695
- Джафарова К.А., Джафаров Э.М. Роль микробиоты в иммунитете и воспалении. Биомедицина (Баку). 2020; 18(3): 4–9. https://doi.org/10.24411/1815-3917-2020-11811
- Belkaid Y., Harrison O.J. Homeostatic immunity and the microbiota. Immunity. 2017; 46(4): 562–76. https://doi.org/10.1016/j.immuni.2017.04.008
- Николаева А.М., Максимчик П.В., Пащенков М.В. Сравнительная характеристика макрофагов, толерантных к агонистам рецепторов NOD1 и TLR4. Иммунология. 2021; 42(2): 102–11. https://doi.org/10.33029/0206-4952-2021-42-2-102-111
- Fitzgerald K.A., Kagan J.C. Toll-like receptors and the control of immunity. Cell. 2020; 180(6): 1044–66. https://doi.org/10.1016/j.cell.2020.02.041
- Mukherjee S., Huda S., Sinha Babu S.P. Toll-like receptor polymorphism in host immune response to infectious diseases: A review. Scand. J. Immunol. 2019; 90(1): e12771. https://doi.org/10.1111/sji.12771
- Kawai T., Akira S. TLR signaling. Semin. Immunol. 2007; 19(1): 24–32. https://doi.org/10.1016/j.smim.2006.12.004
- Gay N.J., Symmons M.F., Gangloff M., Bryant C.E. Assembly and localization of Toll-like receptor signalling complexes. Nat. Rev. Immunol. 2014; 14(8): 546–58. https://doi.org/10.1038/nri3713
- Kagan J.C., Magupalli V.G., Wu H. SMOCs: supramolecular organizing centres that control innate immunity. Nat. Rev. Immunol. 2014; 14(12): 821–6. https://doi.org/10.1038/nri3757
- Snyder M., Snyder G.A. Cobbling together the myddosome. Structure. 2020; 28(6): 598–600. https://doi.org/10.1016/j.str.2020.05.006
- Vidya M.K., Kumar V.G., Sejian V., Bagath M., Krishnan G., Bhatta R. Toll-like receptors: Significance, ligands, signaling pathways, and functions in mammals. Int. Rev. Immunol. 2018; 37(1): 20–36. https://doi.org/10.1080/08830185.2017.1380200
- Азбукина Н.В., Астахова А.А., Гориянов С.В., Чистяков В.В., Сергеева М.Г. Влияние высоко- и низкомолекулярной гиалуроновой кислоты на высвобождение омега-3 и омега-6 кислот при активации Толл-подобных рецепторов в астроцитах. Биологические мембраны: Журнал мембранной и клеточной биологии. 2020; 37(2): 94-102. https://doi.org/10.31857/S0233475519060033
- Foster S.L., Hargreaves D.C., Medzhitov R. Gene-specific control of inflammation by TLR-induced chromatin modifications. Nature. 2007; 447(7147): 972–8. https://doi.org/10.1038/nature05836
- Butcher S.K., O'Carroll C.E., Wells C.A., Carmody R.J. Toll-like receptors drive specific patterns of tolerance and training on restimulation of macrophages. Front. Immunol. 2018; 9: 933. https://doi.org/10.3389/fimmu.2018.00933
- DeFelice M.M., Clark H.R., Hughey J.J., Maayan I., Kudo T., Gutschow M.V., et al. NF-κB signaling dynamics is controlled by a dose-sensing autoregulatory loop. Sci. Signal. 2019; 12(579): eaau3568. https://doi.org/10.1126/scisignal.aau3568
- Latty S.L., Sakai J., Hopkins L., Verstak B., Paramo T., Berglund N.A., et al. Activation of Toll-like receptors nucleates assembly of the MyDDosome signaling hub. eLife. 2018; 7: e31377. https://doi.org/10.7554/eLife.31377
- Sung M.H., Li N., Lao Q., Gottschalk R.A., Hager G.L., Fraser I.D. Switching of the relative dominance between feedback mechanisms in lipopolysaccharide-induced NF-κB signaling. Sci. Signal. 2014; 7(308): ra6. https://doi.org/10.1126/scisignal.2004764
- Novakovic B., Habibi E., Wang S.Y., Arts R., Davar R., Megchelenbrink W., et al. β-Glucan reverses the epigenetic state of LPS-induced immunological tolerance. Cell. 2016; 167(5): 1354–68.e14. https://doi.org/10.1016/j.cell.2016.09.034
- Bundschuh D.S., Barsig J., Hartung T., Randow F., Döcke W.D., Volk H.D., et al. Granulocyte-macrophage colony-stimulating factor and IFN-gamma restore the systemic TNF-alpha response to endotoxin in lipopolysaccharide-desensitized mice. J. Immunol. 1997; 158(6): 2862–71.
- Dobrovolskaia M.A., Medvedev A.E., Thomas K.E., Cuesta N., Toshchakov V., Ren T., et al. Induction of in vitro reprogramming by Toll-like receptor (TLR)2 and TLR4 agonists in murine macrophages: effects of TLR "homotolerance" versus "heterotolerance" on NF-kappa B signaling pathway components. J. Immunol. 2003; 170(1): 508–19. https://doi.org/10.4049/jimmunol.170.1.508
- de Vos A.F., Pater J.M., van den Pangaart P.S., de Kruif M.D., van't Veer C., van der Poll T. In vivo lipopolysaccharide exposure of human blood leukocytes induces cross-tolerance to multiple TLR ligands. J. Immunol. 2009; 183(1): 533–42. https://doi.org/10.4049/jimmunol.0802189
- Bagchi A., Herrup E.A., Warren H.S., Trigilio J., Shin H.S., Valentine C., et al. MyD88-dependent and MyD88-independent pathways in synergy, priming, and tolerance between TLR agonists. J. Immunol. 2007; 178(2); 1164–71. https://doi.org/10.4049/jimmunol.178.2.1164
- Gioannini T.L., Teghanemt A., Zhang D., Coussens N.P., Dockstader W., Ramaswamy S., et al. Isolation of an endotoxin-MD-2 complex that produces Toll-like receptor 4-dependent cell activation at picomolar concentrations. Proc. Natl Acad. Sci. USA. 2004; 101(12): 4186–91. https://doi.org/10.1073/pnas.0306906101
- Lizundia R., Sauter K.S., Taylor G., Werling D. Host species-specific usage of the TLR4-LPS receptor complex. Innate Immun. 2008; 14(4): 223–31. https://doi.org/10.1177/1753425908095957
- Park B.S., Song D.H., Kim H.M., Choi B.S., Lee H., Lee J.O. The structural basis of lipopolysaccharide recognition by the TLR4-MD-2 complex. Nature. 2009; 458(7242): 1191–5. https://doi.org/10.1038/nature07830
- Zanoni I., Ostuni R., Marek L.R., Barresi S., Barbalat R., Barton G.M., et al. CD14 controls the LPS-induced endocytosis of Toll-like receptor 4. Cell. 2011; 147(4): 868–80. https://doi.org/10.1016/j.cell.2011.09.051
- Petes C., Mintsopoulos V., Finnen R.L., Banfield B.W., Gee K. The effects of CD14 and IL-27 on induction of endotoxin tolerance in human monocytes and macrophages. J. Biol. Chem. 2018; 293(45): 17631–45. https://doi.org/10.1074/jbc.RA118.003501
- Lee J., Gonzales-Navajas J.M., Raz E. The "polarizing-tolerizing" mechanism of intestinal epithelium: its relevance to colonic homeostasis. Semin. Immunopathol. 2008; 30(1): 3–9. https://doi.org/10.1007/s00281-007-0099-7
- Burgueño J.F., Abreu M.T. Epithelial Toll-like receptors and their role in gut homeostasis and disease. Nature reviews. Gastroenterol. Hepatol. 2020; 17(5): 263–78. https://doi.org/10.1038/s41575-019-0261-4
- Tidswell M., Tillis W., Larosa S.P., Lynn M., Wittek A.E., Kao R., et al. Phase 2 trial of eritoran tetrasodium (E5564), a toll-like receptor 4 antagonist, in patients with severe sepsis. Crit. Care Med. 2010; 38(1): 72–83. https://doi.org/10.1097/CCM.0b013e3181b07b78
- Lucas K., Maes M. Role of the Toll Like receptor (TLR) radical cycle in chronic inflammation: possible treatments targeting the TLR4 pathway. Mol. Neurobiol. 2013; 48(1): 190–204. https://doi.org/10.1007/s12035-013-8425-7
- Di Lorenzo F., De Castro C., Silipo A., Molinaro A. Lipopolysaccharide structures of Gram-negative populations in the gut microbiota and effects on host interactions. FEMS Microbiol. Rev. 2019; 43(3): 257–72. https://doi.org/10.1093/femsre/fuz002
- Koymans K.J., Feitsma L.J., Bisschop A., Huizinga E.G., van Strijp J., de Haas C., et al. Molecular basis determining species specificity for TLR2 inhibition by staphylococcal superantigen-like protein 3 (SSL3). Vet. Res. 2018; 49(1): 115. https://doi.org/10.1186/s13567-018-0609-8
- Cullen T.W., Schofield W.B., Barry N.A., Putnam E.E., Rundell E.A., Trent M.S., et al. Gut microbiota. Antimicrobial peptide resistance mediates resilience of prominent gut commensals during inflammation. Science. 2015; 347(6218): 170–5. https://doi.org/10.1126/science.1260580
- Brown R.L., Larkinson M., Clarke T.B. Immunological design of commensal communities to treat intestinal infection and inflammation. PLoS Pathog. 2021; 17(1): e1009191. https://doi.org/10.1371/journal.ppat.1009191
- Anstadt E.J., Fujiwara M., Wasko N., Nichols F., Clark R.B. (2016). TLR tolerance as a treatment for central nervous system autoimmunity. J. Immunol. 2016; 197(6): 2110–8. https://doi.org/10.4049/jimmunol.1600876
- Wasko N.J., Nichols F., Clark R.B. Multiple sclerosis, the microbiome, TLR2, and the hygiene hypothesis. Autoimmun. Rev. 2020; 19(1): 102430. https://doi.org/10.1016/j.autrev.2019.102430
- Motshwene P.G., Moncrieffe M.C., Grossmann J.G., Kao C., Ayaluru M., Sandercock A.M., et al. An oligomeric signaling platform formed by the Toll-like receptor signal transducers MyD88 and IRAK-4. J. Biol. Chem. 2009; 284(37): 25404–11. https://doi.org/10.1074/jbc.M109.022392
- Bowie A., Kiss-Toth E., Symons J.A., Smith G.L., Dower S.K., O'Neill L.A. A46R and A52R from vaccinia virus are antagonists of host IL-1 and toll-like receptor signaling. Proc. Natl Acad. Sci. USA. 2000; 97(18): 10162–7. https://doi.org/10.1073/pnas.160027697
- Harte M.T., Haga I.R., Maloney G., Gray P., Reading P.C., Bartlett N.W., et al. The poxvirus protein A52R targets Toll-like receptor signaling complexes to suppress host defense. J. Exp. Med. 2003; 197(3): 343–51. https://doi.org/10.1084/jem.20021652
- Yu H., Bruneau R.C., Brennan G., Rothenburg S. Battle royale: innate recognition of poxviruses and viral immune evasion. Biomedicines. 2021; 9(7): 765. https://doi.org/10.3390/biomedicines9070765
- Moynagh P.N. The Pellino family: IRAK E3 ligases with emerging roles in innate immune signalling. Trends Immunol. 2009; 30(1): 33–42. https://doi.org/10.1016/j.it.2008.10.001
- Strickson S., Emmerich C.H., Goh E., Zhang J., Kelsall I.R., Macartney T., et al. Roles of the TRAF6 and Pellino E3 ligases in MyD88 and RANKL signaling. Proc. Natl Acad. Sci. USA. 2017; 114(17): E3481–9. https://doi.org/10.1073/pnas.1702367114
- Carmody R.J., Ruan Q., Palmer S., Hilliard B., Chen Y.H. Negative regulation of toll-like receptor signaling by NF-kappaB p50 ubiquitination blockade. Science. 2007; 317(5838): 675–8. https://doi.org/10.1126/science.1142953
- Yan Q., Carmody R.J., Qu Z., Ruan Q., Jager J., Mullican S.E., et al. Nuclear factor-κB binding motifs specify Toll-like receptor-induced gene repression through an inducible repressosome. Proc. Natl Acad. Sci. USA. 2012; 109(35): 14140–5. https://doi.org/10.1073/pnas.1119842109
- Черных Е.Р., Олейник Е.А., Леплина О.Ю., Старостина Н.М., Останин А.А. Дендритные клетки в патогенезе вирусного гепатита С. Инфекция и иммунитет. 2019; 9(2): 239–52. https://doi.org/10.15789/2220-7619-2019-2-239-252
- Song R., Gao Y., Dozmorov I., Malladi V., Saha I., McDaniel M.M., et al. IRF1 governs the differential interferon-stimulated gene responses in human monocytes and macrophages by regulating chromatin accessibility. Cell Rep. 2021; 34(12): 108891. https://doi.org/10.1016/j.celrep.2021.108891
- Mages M.J., Dietrich H., Lang R. A genome-wide analysis of LPS tolerance in macrophages. Immunobiology. 2007; 212(9-10): 723–37. https://doi.org/10.1016/j.imbio.2007.09.015
- O'Carroll C., Fagan A., Shanahan F., Carmody R.J. (Identification of a unique hybrid macrophage-polarization state following recovery from lipopolysaccharide tolerance. J. Immunol. 2014; 192(1): 427–36. https://doi.org/10.4049/jimmunol.1301722
- O'Neill L.A., Sheedy F.J., McCoy C.E. MicroRNAs: the fine-tuners of Toll-like receptor signalling. Nat. Rev. Immunology. 2011; 11(3): 163–75. https://doi.org/10.1038/nri2957
- Hewel C., Kaiser J., Wierczeiko A., Linke J., Reinhardt C., Endres K., et al. Common miRNA patterns of Alzheimer's disease and Parkinson's disease and their putative impact on commensal gut microbiota. Front. Neurosci. 2019; 13: 113. https://doi.org/10.3389/fnins.2019.00113
- Carpenter S., Aiello D., Atianand M.K., Ricci E.P., Gandhi P., Hall L.L., et al. A long noncoding RNA mediates both activation and repression of immune response genes. Science. 2013; 341(6147): 789–92. https://doi.org/10.1126/science.1240925
- Seeley J.J., Ghosh S. Molecular mechanisms of innate memory and tolerance to LPS. J. Leukoc. Biol. 2017; 101(1): 107–19. https://doi.org/10.1189/jlb.3MR0316-118RR
- Saeed S., Quintin J., Kerstens H.H., Rao N.A., Aghajanirefah A., Matarese F., et al. Epigenetic programming of monocyte-to-macrophage differentiation and trained innate immunity. Science. 2014; 345(6204): 1251086. https://doi.org/10.1126/science.1251086
- O'Carroll C., Fagan A., Shanahan F., Carmody R.J. Identification of a unique hybrid macrophage-polarization state following recovery from lipopolysaccharide tolerance. J. Immunol. 2014; 192(1): 427–36. https://doi.org/10.4049/jimmunol.1301722
- Fischer C., Metsger M., Bauch S., Vidal R., Böttcher M., Grote P., et al. Signals trigger state-specific transcriptional programs to support diversity and homeostasis in immune cells. Sci. Signal. 2019; 12(581): eaao5820. https://doi.org/10.1126/scisignal.aao5820
- Arts R.J., Joosten L.A., Netea M.G. Immunometabolic circuits in trained immunity. Semin. Immunol. 2016; 28(5): 425–30. https://doi.org/10.1016/j.smim.2016.09.002
- Gambuzza M.E., Sofo V., Salmeri F.M., Soraci L., Marino S., Bramanti P. Toll-like receptors in Alzheimer's disease: a therapeutic perspective. CNS Neurol. Disord. Drug Targets. 2014; 13(9): 1542–58. https://doi.org/10.2174/1871527313666140806124850
- Luchner M., Reinke S., Milicic A. TLR agonists as vaccine adjuvants targeting cancer and infectious diseases. Pharmaceutics. 2021; 13(2): 142. https://doi.org/10.3390/pharmaceutics13020142
- Anwar M.A., Shah M., Kim J., Choi S. Recent clinical trends in Toll-like receptor targeting therapeutics. Med. Res. Rev. 2019; 39(3): 1053–90. https://doi.org/10.1002/med.21553
- Vijay K. Toll-like receptors in immunity and inflammatory diseases: Past, present, and future. Int. Immunopharmacol. 2018; 59: 391–412. https://doi.org/10.1016/j.intimp.2018.03.002
Дополнительные файлы