Роль Т-клеточного иммунитета важно учитывать при создании современных вакцин против клещевого энцефалита
- Авторы: Тигеева Е.В.1, Низоленко Л.Ф.1, Карпенко Л.И.1
-
Учреждения:
- Государственный научный центр вирусологии и биотехнологии «Вектор»
- Выпуск: Том 101, № 4 (2024)
- Страницы: 546-559
- Раздел: ОБЗОРЫ
- URL: https://microbiol.crie.ru/jour/article/view/18605
- DOI: https://doi.org/10.36233/0372-9311-553
- EDN: https://elibrary.ru/icslhy
- ID: 18605
Цитировать
Аннотация
Вирус клещевого энцефалита (КЭ) обладает высокой патогенностью, способен поражать центральную нервную систему, приводя к тяжелейшим хроническим последствиям либо летальному исходу. Единственной эффективной мерой борьбы с КЭ является профилактическая вакцинация. Используемые в настоящее время вакцины, полученные на основе инактивированного вируса КЭ, обеспечивают формирование протективного иммунного ответа, однако такие вакцины требуют многократного введения. Возможной причиной недолгосрочного иммунитета является формирование недостаточно напряжённого Т-клеточного ответа при использовании таких вакцин.
Цель обзора — анализ литературы, содержащей информацию о роли Т-клеточного иммунного ответа в защите организма от КЭ, о его значении для разработки вакцин, а также рассмотрение подходов к разработке новых вакцин против КЭ на основе различных платформ.
При подготовке обзора был проведён анализ литературы, представленной в базах PubMed, Scopus, Elsevier, Google Scholar по состоянию на апрель 2024 г. Для поиска использовали следующие ключевые слова: vaccine, tick-borne encephalitis virus, T-cell immune response, flaviviruses, вакцины, вирус клещевого энцефалита, Т-клеточный иммунный ответ, флавивирусы.
В ряде публикаций продемонстрировано, что структура Т-клеточного ответа при естественном заражении вирусом КЭ и после вакцинации инактивированным вирусом различна. В ходе вирусной инфекции активируются CD4+-Т-клетки как Th1-, так и Th2-типа, а также CD8+-Т-клетки, играющие важную роль в элиминации вирусной инфекции. После вакцинации преобладает ответ CD4+-Т-клеток по Th2-типу, что может являться причиной недолговечного иммунного ответа.
На сегодняшний день исследуется ряд различных типов экспериментальных вакцин против КЭ, таких как вакцины на основе живых аттенуированных вирусов, вакцины на основе вирусных векторов, вирусоподобные частицы, субъединичные вакцины, ДНК- и мРНК-вакцины, полиэпитопные иммуногены. В плане активации Т-клеточного ответа наиболее перспективными выглядят вакцины на основе Т-клеточных полиэпитопных иммуногенов, доставляемых в форме ДНК или мРНК.
Полный текст
Широкое распространение вируса КЭ вызывает серьёзные опасения у органов здравоохранения многих стран. Это связано с тем, что вирус, обладая высокой патогенностью, способен поражать центральную нервную систему (ЦНС), приводя к тяжелейшим хроническим последствиям либо летальному исходу [1–3].
В 30% случаев у людей, перенёсших КЭ, развиваются неврологические осложнения. Смертность от инфекции варьирует в зависимости от штамма вируса. Наиболее высокий процент летальных случаев (до 35%) регистрируют при заражении штаммами, принадлежащими к дальневосточному субтипу [4–6].
Наиболее эффективным способом борьбы с вирусом является вакцинопрофилактика. Все лицензированные на сегодняшний день вакцины созданы на основе штаммов инактивированного вируса КЭ. Принято считать, что средний уровень сероконверсии как для российских, так и для европейских вакцин колеблется в интервале 86–100%, что обеспечивает формирование защитного иммунитета у вакцинированных [2, 7]. В то же время вакцины на основе инактивированного вируса КЭ имеют ряд недостатков: сложный график вакцинации, относительно высокая реактогенность, сложность производства и хранения; кроме того, встречаются случаи прорывных инфекций у вакцинированных [2, 8, 9]. Среди привитых заболеваемость КЭ колеблется, в зависимости от эндемичного региона, от 3,7% [10] до 23,8% [11] от общего числа заболевших. Одной из возможных причин прорывных инфекций является отсутствие вакцин, учитывающих генетическую вариабельность вируса КЭ. Другая причина связана с недостаточно напряжённым и непродолжительным специфическим иммунитетом у ряда вакцинированных, особенно у пожилых людей [7–9, 12].
Т-клеточное звено иммунного ответа является важной частью защитного иммунитета против вирусных инфекций, таких как КЭ. Появляется всё больше публикаций, посвящённых роли Т-клеточного иммунного ответа в защите от инфекции, вызванной вирусом КЭ. Поэтому всё больше исследователей стали обращать внимание на этот аспект адаптивного иммунного ответа, особенно в контексте исследований, посвящённых разработке новых вакцинных препаратов [7, 13]. Широкое распространение вируса и активный рост числа заболевших стимулировали интерес к разработке новых вакцин против КЭ, учитывающих роль Т-клеточного иммунного ответа.
Целью обзора является анализ литературы, содержащей информацию о роли Т-клеточного иммунного ответа в защите организма от КЭ, о его значении для разработки вакцин, а также рассмотрение подходов к разработке новых вакцин против КЭ на основе различных платформ.
В данном обзоре мы рассматриваем основные аспекты формирования Т-клеточного ответа у людей при заражении вирусом КЭ и после вакцинации лицензированными вакцинами, а также основные направления работ по поиску безопасных и высокоэффективных вакцин нового поколения, способных преодолеть ограничения существующих.
Материалы и методы
При подготовке обзора был проведён анализ литературы, представленной в научных базах PubMed, Scopus, Elsevier, Google Scholar, по состоянию на апрель 2024 г. Для поиска использовали следующие ключевые слова: vaccine, tick-borne encephalitis virus, T-cell immune response, flaviviruses, вакцины, вирус клещевого энцефалита, Т-клеточный иммунный ответ, флавивирусы.
На первом этапе в научной электронной базе PubMed при поиске с использованием различных сочетаний ключевых слов было найдено 1754 источника. Ограничение поиска по времени написания публикаций с 2019 по 2024 г. позволило сузить их количество до 424 источников. Поиск без учёта года издания в данной научной библиотеке обнаружил еще 123 источника, соответствующих тематике. Подобным образом поиск был проведён с помощью научных баз Scopus, Elsevier, Google Scholar.
В ходе поиска литературы в перечисленных базах данных на русском и английском языках, проводившемся с учётом таких критериев отбора, как год издания и доступность публикаций к прочтению, было проанализировано около 2000 источников, соответствующих тематике. В связи с ограничением по объёму статьи были отобраны 88 источников.
Адаптивный иммунный ответ при заражении вирусом КЭ и после вакцинации
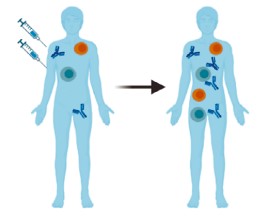
Адаптивный иммунный ответ составляют специфические для вируса КЭ гуморальный (опосредованный антителами) и клеточный иммунные ответы. На рисунке схематически представлены иммунные реакции адаптивного иммунного ответа, возникающие после вакцинации либо при заражении вирусом КЭ.
Иммунные реакции, возникающие после заражения вирусом КЭ (А) и после вакцинации против КЭ (Б) (по R. Ackermann-Gäumann и соавт. [13]).
Immune reactions occurring after infection with the TBE virus and after vaccination against TBE (adapted from R. Ackermann-Gäumann et al. [13]).
Эффективность антител к вирусу КЭ продемонстрирована защитой восприимчивых лиц, подвергшихся воздействию вируса, путём введения им анти-ВКЭ-иммуноглобулина. Считается, что гуморальный иммунитет играет решающую роль в защите от вируса КЭ, обеспечивая синтез антител, специфически нацеленных на вирус. Эти антитела нейтрализуют вирус и предотвращают его распространение, помогая ограничить тяжесть инфекции и обеспечивая долгосрочный иммунитет против заражения вирусом КЭ (рисунок, А). Антитела способны связываться с вирусными частицами, вызывая их поглощение и разрушение фагоцитирующими иммунными клетками [7, 13].
У человека, который перенёс КЭ, формируются В-клетки памяти и вируснейтрализующие антитела, которые обеспечивают длительную защиту от повторного заражения вирусом. Долгосрочное поддержание В-клеток памяти позволяет иммунной системе быстрее и эффективнее реагировать на повторное заражение. При очередной встрече с тем же вирусом эти клетки быстро дифференцируются в плазматические клетки, продуцирующие антитела, которые уничтожают вирус до того, как он сможет вызвать широко распространённую инфекцию и заболевание [13–16].
При вакцинации инактивированным вирусом функциональность популяций В-клеток памяти сохраняется относительно недолго, что связано с ограниченностью ответов со стороны CD4+-Т-клеток (рисунок, Б) [17].
Иммунный ответ, связанный с CD4+-Т-клетками
CD4+-Т-лимфоциты имеют важное значение в формировании как гуморального, так и клеточного звена иммунитета. CD4+-Т-клетки продуцируют цитокины, которые помогают стимулировать противовирусный иммунный ответ и оказывать В-клеткам помощь, необходимую для стимуляции синтеза антител (рисунок, А). Вирус КЭ кодирует 7 неструктурных белков (NS1, NS2a, NS2b, NS3, NS4a, NS4b и NS5) и только 3 структурных белка: белок C (капсид) и мембраноассоциированные белки prM/M (предшественник мембраны/мембраны) и E (оболочка) [18–20]. Структурные белки, по-видимому, содержат основные эпитопы, активирующие ответ CD4+-Т-клеток во время инфекции [8, 21], хотя в литературе встречаются данные о том, что несколько Т-хелперных эпитопов содержится в неструктурном белке вируса КЭ — NS1 [22].
При анализе пептидных фрагментов, объединяющих предсказанные иммунодоминантные эпитопы из белка С, было показано, что в активации CD4+-клеток участвуют главным образом два кластера пептидов как при естественном заболевании, так и после вакцинации. Они располагаются в α2- и α4-спиралях белка С [21]. Менее эффективными в отношении активации CD4+ оказались пулы эпитопов, предсказанные для белка E, однако эту разницу нельзя считать значительной. Обнаружено, что у пациентов, перенёсших естественную инфекцию, специфическую стимуляцию CD4+-клеток обеспечивают эпитопы, расположенные в третьем домене, а также «стержневой» области Е-белка. В группе вакцинированных пациентов стимуляцию обеспечивали пептидные кластеры из первого, второго и третьего доменов Е-белка [21].
Специфичные для вируса КЭ CD4+-Т-клетки, образующиеся в результате вакцинации, по-видимому, реагируют на более узкий диапазон вирусных мишеней по сравнению с теми, которые образуются в результате инфекции [8, 21], при этом уровни интерферона-γ (ИФН-γ), вызванные вакцинацией, достигают лишь около половины от уровня ответа, вызванного инфекцией.
Примечательно, что после естественного заражения вирусом КЭ наивные CD4+-клетки дифференцируются преимущественно по пути Th1, а при вакцинации инактивированным вирусом — в большей степени по пути Th2 [8, 9]. При этом на фоне естественной инфекции CD4+-Т-клетки приобретают полифункциональность, продуцируя различные цитокины, такие как интерлейкин-2 (ИЛ-2), ИФН-γ и фактор некроза опухоли-α (ФНО-α; рисунок, А) [4]. Существует корреляция между функциональностью CD4+-Т-клеток и уровнем вируснейтрализующих антител, что указывает на то, что они способны контролировать индукцию нейтрализующих антител [8].
После вакцинации количество CD4+-Т-клеток также положительно коррелирует с ответом антител против вируса КЭ [17], а у лиц, ответивших на вакцину, наблюдается повышенная пролиферация антигенспецифических Т-клеток по сравнению с лицами, не ответившими на вакцину (рисунок, А) [23]. Реакция на вакцинацию, как правило, смещена в сторону продукции ИЛ-2 и ФНО-α по сравнению с инфекцией (рисунок, Б) [9].
Иммунный ответ, связанный с CD8+-Т-клетками
CD8+-Т-лимфоциты играют важную роль в вирусной инфекции, идентифицируя и уничтожая инфицированные клетки, тем самым ограничивая распространение вируса в организме. На данный момент, в отличие от CD4+-Т-клеток, специфические для CD8+-Т-лимфоцитов эпитопы были обнаружены только в неструктурных белках вируса КЭ, таких как NS2A, NS3, NS4B и NS5 [24].
CD8+-Т-клетки при естественном заражении активируются несколько позже, чем CD4+-Т-клетки, однако, несмотря на это, имеют значительно более высокий уровень активации, продуцируя повышенные уровни гранзима В и перфорина [4, 7].
K. Blom и соавт. показали, что у пациентов с КЭ на пике Т-клеточного ответа через 1 нед после госпитализации активация CD8+-Т-клеток была существенно увеличена по сравнению с CD4+-Т-клетками [25], что указывает на тенденцию к доминированию CD8+ (рисунок, А). Эти CD8+-Т-клетки дополнительно демонстрировали эффекторный фенотип (CD45RA-CCR7) [24, 25] и имели высокоактивированный транскрипционный профиль Eomes+Ki67+T-bet+. Однако эти эффекторы, как правило, были монофункциональными. После острой инфекции, когда пациенты выздоравливали, антигенспецифические CD8+-Т-клетки перешли к фенотипу Eomes-Ki67-T-bet+ [25], что соответствует популяции эффекторной памяти 1-го типа.
Как правило, анализ CD8+-Т-клеток проводят у пациентов с тяжёлым течением заболевания, у которых CD8+-Т-клетки обнаруживают не только в крови, но иногда и в тканях мозга [13]. Этот факт ограничивает понимание того, является ли популяция CD8+ важным фактором защиты при лёгком или бессимптомном заболевании, либо дополнительным фактором, вызывающим патологию [13]. В пользу необходимости CD8+-Т-клеток для защиты организма от вируса КЭ свидетельствуют недавно полученные данные о том, что тяжесть заболевания, а также его форма зависят от степени активации Т-клеток. Ранняя активация ответов Т-клеточного ответа, в том числе подмножества CD8+-Т-лимфоцитов, значительным образом коррелировала с благоприятным исходом заболевания [26].
Результаты исследований на животных также неоднозначны. В работе D. Růzek и соавт. показано, что у мышей с тяжёлым иммунодефицитом и у мышей с нокаутом CD8 выживаемость после летальной инфекции, вызванной вирусом КЭ, выше по сравнению с мышами дикого типа или мышами с адоптивно перенесёнными CD8+-Т-клетками [27]. Это может свидетельствовать о возможной роли CD8+-Т-клеток в развитии летальной инфекции. Впоследствии D. Růzek и соавт. получили данные, указывающие на то, что CD8+-Т-клетки не несут ответственности за проницаемость гематоэнцефалического барьера во время заболевания, поскольку его разрушение во время инфекции, вызванной данным вирусом, наблюдалось как у животных дикого типа, так и у животных с нокаутом по CD8 [28].
Роль CD8+-Т-клеток в клиренсе вируса из нервных тканей показана для других флавивирусных инфекций с использованием мышей в качестве лабораторных животных [29]. Истощение CD8+-Т-клеток приводило к усилению инфекции, вызванной вирусами Зика и денге, но этот эффект исчезал после адоптивного переноса CD8+-Т-клеток памяти. Аналогичные результаты были получены при использовании мышей с дефицитом различных цитотоксических эффекторных молекул при лихорадке Западного Нила. На начальных этапах инфекций, вызываемых вирусами жёлтой лихорадки и Зика, когда у мышей ещё не сформировался достаточный уровень вирусспецифических антител, эффекторные CD8+-Т-клетки необходимы для контроля инфекции [29].
Данных об обнаружении специфических CD8+-Т-клеток у людей, получивших вакцину против КЭ, не много (рисунок, Б). A. Sycheva и соавт. исследовали формирование Т-клеточного ответа у добровольцев, вакцинированных «Клещ-Э-Вак», и показали, что в периферической крови вакцинированных обнаруживается низкий уровень CD8+, специфичных к вирусу КЭ, а общий ответ на вакцину явно зависит от CD4+ [30, 31].
Как уже упоминалось выше, основные эпитопы CD8+-Т-клеток содержатся в неструктурных белках вируса [24]. Поскольку неструктурные белки синтезируются только во время активной репликации вируса, в используемых в настоящее время вакцинах, основанных на инактивированном вирусе, такие белки обнаруживаются в небольших количествах или полностью отсутствуют [32]. Этот факт может частично объяснить низкий ответ CD8+-Т-клеток в ходе вакцинации. При этом инфекция КЭ может вызывать пожизненный защитный ответ CD8+ [14].
Ниже будет рассмотрен ряд вакцинных платформ с точки зрения возможности индуцирования Т-клеточного иммунного ответа.
Вакцины против клещевого энцефалита
Вакцины на основе инактивированного вируса
В настоящее время существует ряд одобренных и лицензированных для взрослых и детей вакцин против КЭ, полученных на основе инактивированных штаммов вируса [33]. В Европе доступны 2 вакцины, разработанные с использованием европейских штаммов вируса КЭ: K23 и Neudorfl. В России лицензированы вакцины «Клещ-Э-Вак», его лиофилизированный аналог «КЭ Москва» (ФНЦ ИБП РАН им. Чумакова) и «ЭнцеВир» («Микроген»), которые основаны на дальневосточных штаммах вируса КЭ Софьин и 205 соответственно [12, 34–36]. Вакцина, применяемая в Китае, содержит штамм Sen-Zhang (дальневосточный подтип вируса КЭ) [37]. Вакцинация против КЭ доказала свою эффективность, о чём свидетельствуют результаты кампаний массовой вакцинации в Австрии [38] и России [39–42].
Все лицензированные вакцины способны обеспечить достаточно эффективную профилактику КЭ, особенно при реализации масштабных программ вакцинации населения. Однако существующие вакцины не лишены недостатков, к которым относится сложная схема вакцинации, обусловленная невозможностью поддерживать должный уровень иммунной защиты в долгосрочной перспективе. Несоблюдение графика вакцинации пациентом может приводить к низкому уровню гуморального иммунного ответа у вакцинированных, особенно у пожилых людей [2, 7].
Вакцинация инактивированным вирусом индуцирует заведомо более низкие титры антител, чем естественная инфекция [7]. Считается, что это может быть связано с изменением конформации Е-белка в результате воздействия на вирусную частицу формальдегида в процессе инактивации. Таким образом, доступность эпитопов, связываемых с нейтрализующими антителами, снижается [43]. Как уже отмечалось, существует разница в иммунном ответе на инфекцию и вакцинацию инактивированным вирусом, которая связана с ограниченностью ответов Т-клеточного звена — малым числом специфических CD8+-Т-лимфоцитов, а также сниженной функциональностью CD4+-клеток (рисунок, Б). В ответ на инактивированный вирус формируются моно- или бифункциональные CD4+-Т-клетки, способные продуцировать, например, только ИЛ-2 или только ИЛ-2 и ФНО-α, но уровень секреции ИФН-γ значительно снижен по сравнению с естественной инфекцией [4, 8]. Вакцинация приводит к смещению ответа в сторону Th2-пути, в то время как при естественном заболевании клеточный ответ формируется, как правило, по Th1-пути, что может сказываться на эффективности защиты от вируса [7, 44]. В идеале вакцины должны вызывать более устойчивые реакции CD4+-Т-клеток, продуцирующих ИФН-γ.
К недостаткам вакцин, полученных на основе инактивированных вирусов, можно отнести также тот факт, что для их производства используется только конкретный штамм вируса КЭ и не учитывается его генетическая вариабельность. В результате этого в эндемичных регионах число «прорывных» инфекций среди вакцинированных лиц может достигать 23,8% от общего числа заболевших [11]. Тем не менее данное направление пока остаётся главенствующим при создании вакцин. В 2017 г. I/II фазу клинических испытаний завершила вакцина «Evervac» [45]. Главным отличием этой вакцины от аналогов является отсутствие в составе адъювантов, а также наработка вируса на клетках Vero, что позволяет добиться улучшенного профиля безопасности. Однако проблема, связанная с неполнотой Т-клеточного ответа, так и не была решена [45].
Подходы к разработке вакцин против КЭ и индукция клеточного иммунитета
На данный момент исследования кандидатных вакцин против КЭ и других флавивирусов сосредоточены на достижении сразу нескольких задач:
- достичь высокой иммуногенности во всех возрастных группах и группах риска;
- обеспечить быстрый и высокий уровень сероконверсии;
- обеспечить формирование долговременного иммунного ответа, избегая сложных схем иммунизации;
- снизить побочные эффекты;
- обеспечить перекрёстный защитный иммунитет против нескольких подтипов вируса КЭ и индукцию эффективного СD4+- и CD8+-клеточного ответа [7].
Помимо широко используемого подхода к созданию вакцин против КЭ на основе инактивированного вируса, на данный момент разрабатывается целый ряд профилактических препаратов, базирующихся на других вакцинных платформах [7].
Живые аттенуированные вакцины
Живые аттенуированные вирусы, утратившие на генетическом уровне патогенные свойства, но содержащие те же антигены, что и исходный патоген, и сохранившие способность вызывать в организме естественную инфекцию в ослабленной форме, способствуют формированию выраженного и длительного В- и Т-клеточного иммунитета, по напряжённости приближающегося к постинфекционному [46]. Первые попытки аттенуации вируса КЭ не были успешными, поэтому в качестве более перспективного источника штаммов для живых аттенуированных вакцин против КЭ стали рассматривать открытый в 1956 г. вирус Лангат ТР-21 [7, 19]. Однако крупное исследование с участием 650 тыс. добровольцев показало, что, помимо индукции высокого уровня иммунной защиты, среди вакцинируемых ослабленным вирусом Лангат часто наблюдалось развитие серьёзных неврологических последствий, в том числе энцефалита [7]. Последующие исследования по разработке вакцин против КЭ на основе аттенуированных вирусов продолжились в направлении улучшения их профиля безопасности. В качестве основных мишеней для ослабления фенотипа выбирались такие белки, как C, E и NS5, что в конечном итоге позволило получить несколько кандидатных вакцин, обладающих низкой реактогенностью и обеспечивающих высокий уровень продукции антител и Т-клеточного ответа [47–49].
Активно ведутся работы по получению химерных вирусов, сочетающих в себе фрагменты геномов вируса КЭ, чаще всего — гены белков Е и prM, а также вирусов лихорадки Западного Нила, денге и Лангат [7, 50].
Хотя вакцины на основе живых аттенуированных вирусов вызывают серьёзные опасения по поводу их безопасности, тем не менее в мире лицензировано уже несколько вакцин против инфекций, вызываемых другими представителями флавивирусов: против жёлтой лихорадки (YFV-17D), японского энцефалита (IMOJEV) и лихорадки денге (Dengvaxia). Две четырёхвалентные живые аттенуированные вакцины против лихорадки денге, производимые «Takeda Pharmaceutical» и «NIH/Butantan», успешно прошли III фазу клинических испытаний [50].
Субъединичные вакцины
По сравнению с живыми аттенуированными вакцинами производство и применение субъединичных вакцин отличается безопасностью, благодаря возможности включения в вакцину отдельных антигенных составляющих в виде вирусных белков или их фрагментов. Однако субъединичные вакцины вызывают в основном только гуморальный иммунный ответ и ограниченный спектр реакций со стороны Т-клеточного звена иммунитета. Они не способны индуцировать длительный иммунный ответ, вследствие чего требуются включение адъювантов в их состав и бустерные иммунизации.
Множество потенциальных вакцин, разрабатывающихся против КЭ и инфекций, вызываемых другими флавивирусами, создавались на основе структурного белка Е или его субъединиц, содержащих эпитопы, узнаваемые нейтрализующими антителами [7]. Было показано, что иммунизация мышей рекомбинантным EDIII-доменом белка Е в сочетании с различными адъювантами позволяет добиться не только индукции нейтрализующих антител, но и частичной защиты от заражения вирусом [51]. В клинических испытаниях показывают значительные успехи субъединичные вакцины против лихорадок денге (V180) и Западного Нила (WN-80E), в состав которых входят усечённые формы белка Е с адъювантами [50].
Вирусоподобные частицы
Вирусоподобные частицы (ВПЧ) формируются в результате одновременного синтеза структурных белков, чаще всего prM/Е, в различных системах экспрессии. Структура ВПЧ приближена к нативной структуре вириона КЭ, что позволяет обеспечить представление максимального числа Т- и В-клеточных эпитопов иммунокомпетентным клеткам. Такие вакцины характеризуются отсутствием потенциальных патогенных свойств и высоким уровнем безопасности [50]. Введение ВПЧ сопровождается индукцией высокого титра вируснейтрализующих антител, активацией CD4+-Т-клеток, а также формированием Т-клеток центральной и эффекторной памяти [7]. В одной из работ по исследованию иммуногенных свойств ВПЧ на модели мышей было показано, что иммунизация ВПЧ способствует дифференцировке CD4+-Т-клеток по Th2-пути с преобладанием фенотипа ИЛ-4+ [52]. В аналогичном исследовании был косвенно подтверждён этот результат. После введения ВПЧ мышам наблюдали формирование напряжённого гуморального иммунного ответа; вместе с тем анализ CD4+-Т-клеток на ИФН-γ, ИЛ-2 и ФНО-α показал отсутствие существенной разницы между экспериментальной и контрольной группами [53].
Вакцины на основе вирусных векторов
При разработке вакцин против КЭ и заболеваний, вызываемых родственными ему вирусами, применяется также подход, зарекомендовавший свою эффективность при борьбе с другими инфекциями, — вакцины на основе вирусных векторов. Такие вакцины представляют собой рекомбинантные или модифицированные вирусы, кодирующие определённые антигены и характеризующиеся способностью или неспособностью к репликации после введения в организм. Основным преимуществом вакцин на основе вирусных векторов является их высокая иммуногенность, обусловленная внутриклеточной экспрессией антигенов и присутствием самого вирусного вектора, который может играть роль «естественного» адъюванта [50].
Однако, как и в случае с живыми аттенуированными вакцинами, подход на основе вирусных векторов, особенно способных к репликации, вызывает вопросы к безопасности их применения в связи с повышенными рисками высокой виремии и потенциальной возможности приобретения патогенных свойств. При введении вакцин на основе вирусного вектора формируется антивекторный иммунный ответ, что снижает эффективность вакцин при повторной иммунизации. К недостаткам таких вакцин следует отнести также сложность и дороговизну их производства [50].
В работах по созданию экспериментальных вакцин против флавивирусных инфекций применяются вектора на основе таких вирусов, как рекомбинантный вирус гриппа А, рекомбинантный аденовирус, модифицированный вирус осповакцины и др. [7]. Различные сочетания антигенов вируса КЭ, которые закодированы в геном вирусного носителя, позволяют при необходимости модулировать иммунный ответ. Так, в ряде работ было показано, что различные вирусные векторы, кодирующие последовательности NS1, индуцируют синтез вируснейтрализующих антител, а также обеспечивают частичную защиту против вируса КЭ [54]. При этом такие вакцины способны активировать и Т-клеточное звено иммунитета, индуцируя образование CD4+- и CD8+-Т-лимфоцитов, продуцирующих ИФН-γ, ИЛ-2 и ФНО-α. Модифицированный вирус осповакцины Анкара, кодирующий последовательность белков вируса КЭ prM и E, при введении мышам также индуцировал высокие уровни вируснейтрализующих антител и специфического Т-клеточного ответа и обеспечивал полную защиту от заражения вирусом [55]. Схожие результаты были получены и в исследовании, посвящённом изучению свойств кандидатной вакцины против лихорадки Зика на основе рекомбинантного вируса везикулярного стоматита, кодирующего белки prM, Е и NS1 [56].
Несмотря на эффективность использования вирусных векторов в качестве одной из платформ для разработки вакцин, на сегодняшний день до стадии клинических испытаний дошла только одна вакцина. MV-ZIKV против лихорадки Зика разработана на платформе штамма Schwarz вируса кори и проходит фазу I клинических испытаний [57].
мРНК- и ДНК-вакцины
В последнее время активно развиваются технологии создания вакцин с использованием нуклеиновых кислот — ДНК- и мРНК-вакцины. Внутриклеточная экспрессия антигенов, кодируемых вакцинами на основе нуклеиновых кислот, позволяет обеспечить нативную структуру белков благодаря посттрансляционным модификациям [58]. Это имеет важное значение для дальнейшего процессинга антигена, его презентации на поверхности иммунных клеток, активации как CD4+-, так и CD8+-Т-клеток.
Технология производства таких вакцин не требует сложных манипуляций или работы с опасными патогенами, что значительно облегчает процесс их создания и снижает его общую стоимость [58]. Кроме того, считается, что применение таких вакцин является более безопасным по сравнению с традиционными подходами [59].
Однако следует отметить, что вакцины на основе нуклеиновых кислот в «голом» виде имеют низкую иммуногенность, поэтому для повышения эффективности используются различные способы доставки к иммунокомпетентным клеткам, включая химические и физические способы [50].
Опубликован ряд работ по получению экспериментальных вакцин против КЭ на основе нуклеиновых кислот. Получена экспериментальная вакцина на основе самореплицирующейся неинфекционной РНК вируса КЭ, содержащей несколько делеций в области гена С-белка, а также точечных мутаций в области гена prM, но не утратившей репликативной функции. Полученная мРНК-вакцина эффективно индуцировала не только гуморальный, но и клеточный ответ, активируя CD8+-клетки, а также ответ CD4+-Т-клеток Th1-типа [60–62].
ДНК-вакцины обладают преимуществом перед мРНК-вакцинами благодаря большей стабильности и меньшей требовательности к условиям хранения. В работах Y. Omori-Urabe и соавт. [63] и группы исследователей из Венского университета (Австрия) [64] описаны ДНК-конструкции в виде плазмидных и вирусных векторов, кодирующих белки E и prM. Иммунизация этими конструкциями индуцировала сильный иммунный ответ и высокий уровень вируснейтрализующих антител. Как правило, при введении таких вакцин наблюдали Th1-путь дифференцировки CD4+-клеток, сопровождавшийся продукцией ИФН-γ, ФНО-α и ИЛ-2, однако при этом была продемонстрирована некоторая вариабельность сдвига соотношения Th1/Th2 в зависимости от использования тех или иных методов доставки [64].
В настоящее время проходят клинические испытания нескольких экспериментальных мРНК- и ДНК-вакцин против других флавивирусных инфекций (вызываемых вирусами денге, Зика и лихорадки Западного Нила), и ряд вакцин находятся на стадии доклинических исследований [50].
Полиэпитопные вакцины
Данная вакцинная платформа специализируется на конструировании именно Т-клеточных иммуногенов и опирается на две основные стратегии. Первая полиэпитопная стратегия основана на разработке искусственных генов, доставляемых плазмидной ДНК, мРНК либо вирусным вектором, кодирующими цепочки CD4+- и CD8+-эпитопов различных белков вируса, соединённых линкерами, выстроенных в одну искусственную конструкцию вакцины. Эта стратегия даёт исследователю свободу выбора эпитопов, что обеспечивает более узкую фокусировку ответов на предпочтительных эпитопах [65]. Современные знания о механизмах формирования CD4+- и CD8+-ответа на продуктивную вирусную инфекцию позволяют разработать алгоритмы для оптимального отбора Т-клеточных эпитопов целевого патогена с учётом особенностей главного комплекса гистосовместимости (major histocompatibility complex, MHC) конкретного генотипа. В настоящее время существуют базы данных эпитопов, такие как Immune Epitope Database [66], разработаны программы, позволяющие предсказывать Т-клеточные эпитопы в различных вирусных белках, и программы для рационального дизайна вакцин, например, PolyCTLDesigner [67].
Вторая стратегия заключается в конструировании химерных иммуногенов, созданных из более длинных участков белков, охватывающих наиболее консервативные регионы вирусных белков, в которых концентрируются Т-клеточные эпитопы [65]. Биоинформатические подходы, которые применяются при оптимизации соединений эпитопов для полиэпитопных вакцин, используются также при разработке консервативных химерных полиэпитопных белков.
За последние 3 года опубликовано множество работ, посвящённых конструированию полиэпитопных иммуногенов флавивирусов (Зика [68], денге [69], Повассан [70, 71] и жёлтой лихорадки [72]), а также SARS-CoV-2 [73–77], вируса Эбола [78–80], вируса Марбург [81], гриппа [82–85] и др. Иммуногенность полиэпитопных ВИЧ-1 вакцин оценивалась в ходе клинических испытаний [86, 87].
В работе Д.Н. Кисакова и соавт. описана экспериментальная ДНК-вакцина против КЭ, кодирующая искусственный полиэпитопный иммуноген вируса КЭ [88]. В состав иммуногена вошли предсказанные эпитопы из основных белков вируса КЭ (NS1, NS3, NS5 и Е), рестриктируемые самыми распространёнными человеческими алломорфами молекул HLA I типа и аллельными вариантами молекул MHC I типа, характерными для мышей линии BALB/c. Введение данной вакцины индуцирует формирование защитного вирусспецифического Т-клеточного ответа у мышей и обеспечивает 50% защиту иммунизированных животных от заражения 100 ЛД50 вируса КЭ (штамм 205).
Иммуногены, спроектированные с использованием компьютерных методов предсказания Т-клеточных эпитопов и рационального дизайна полиэпитопных антигенов, могут стать основой новых эффективных способов иммунопрофилактики инфекционных заболеваний. С их использованием могут проектироваться как «универсальные» антигенные конструкции, охватывающие значительную часть целевой человеческой популяции, так и персонифицированные конструкции, составленные с учётом генетических особенностей конкретного пациента (с учётом его репертуара аллельных вариантов молекул MHC I и/или II класса).
Оптимальным путем повышения эффективности вакцин против вирусных инфекций может быть интегрированная стратегия, которая сочетает использование двух иммуногенов в системе прайм–буст, один из которых индуцирует вируснейтрализующие антитела (например, классическая инактивированная вакцина), а другой — ответы Т-клеток (полиэпитопный иммуноген).
Заключение
С накоплением данных об особенностях адаптивного иммунного ответа при КЭ приходит понимание роли Т-клеточного ответа в протективном иммунитете при инфекции и вакцинации, а также его влияния на исход заболевания. Структура Т-клеточного ответа при естественном заражении вирусом КЭ и после вакцинации инактивированным вирусом различается. После инфицирования активируются полифункциональные CD4+-Т-клетки как Th1-, так и Th2-типа, а также монофункциональные CD8+-Т-клетки, играющие важную роль в элиминации вирусной инфекции. Отсутствие в составе инактивированных вакцин неструктурных белков вируса КЭ, несущих основные эпитопы CD8+-Т-лимфоцитов, приводит к активации лишь части Т-клеточного иммунного ответа, представленного CD4+-Т-клетками Th2-типа, осуществляющими главным образом поддержку для В-клеточного ответа. Таким образом, неполнота Т-клеточного иммунного ответа, возникающего после вакцинации классическими вакцинами, приводит к сниженной функциональности клеток памяти, что может лежать в основе недолгосрочности протективного ответа на вакцину.
Ряд вопросов относительно Т-клеточного ответа остаются не вполне ясными, в том числе нет единого мнения по поводу роли CD8+ в развитии патологического процесса в ходе инфекции. Тем не менее многие исследователи приходят к выводу, что необходимым условием ограничения проникновения вируса КЭ в органы ЦНС и смягчения иммунной патологии является высокий уровень вируснейтрализующих антител в сочетании с Т-клеточным ответом, включающим ответ специфических CD8+-Т-клеток.
Внимание к Т-клеточному ответу продолжает расти также в связи с необходимостью улучшения классических инактивированных вакцин против КЭ. Исследования вакцин нового поколения сосредоточены на поиске такой стратегии, которая позволила бы обеспечить сбалансированный гуморальный и Т-клеточный иммунный ответ. На сегодняшний день было исследовано множество типов вакцин, представляющих собой живые аттенуированные вирусы, субъединичные вакцины, вакцины на основе вирусных векторов, вирусоподобные частицы, субъединичные вакцины, ДНК- и мРНК-вакцины, полиэпитопные иммуногены. На наш взгляд, в плане активации Т-клеточного ответа наиболее перспективными выглядят вакцины на основе Т-клеточных полиэпитопных иммуногенов, доставляемых в форме ДНК или мРНК. Оптимальным путём к повышению эффективности вакцины может быть интегрированная стратегия, которая сочетает в себе использование двух иммуногенов в системе prime-boost, один из которых индуцирует вируснейтрализующие антитела, а другой — ответы Т-клеток.
Разработка безопасной, эффективной вакцины против КЭ, обеспечивающей формирование сбалансированного Т- и B-клеточного иммунитета, станет важным достижением в борьбе с КЭ.
Об авторах
Елена Витальевна Тигеева
Государственный научный центр вирусологии и биотехнологии «Вектор»
Автор, ответственный за переписку.
Email: tigeeva_ev@vector.nsc.ru
ORCID iD: 0009-0001-5203-2130
м.н.с. отдела биоинженерии
Россия, р.п. КольцовоЛилия Филипповна Низоленко
Государственный научный центр вирусологии и биотехнологии «Вектор»
Email: tigeeva_ev@vector.nsc.ru
ORCID iD: 0000-0002-9647-4969
к.б.н., с.н.с. отдела биоинженерии
Россия, р.п. КольцовоЛариса Ивановна Карпенко
Государственный научный центр вирусологии и биотехнологии «Вектор»
Email: tigeeva_ev@vector.nsc.ru
ORCID iD: 0000-0003-4365-8809
д.б.н., зав. лабораторией рекомбинантных вакцин, в.н.с. отдела биоинженерии
Россия, р.п. КольцовоСписок литературы
- Хаснатинов M.A. Роль генетического разнообразия вируса клещевого энцефалита и других клещевых патогенов в обеспечении устойчивого существования их эпидемиологически значимых природных очагов в Восточной Сибири и Монголии: Дисс. … д-ра биол. наук. Иркутск;2019. Khasnatinov M.A. The role of the genetic diversity of tick-borne encephalitis virus and other tick-borne pathogens in ensuring the sustainable existence of their epidemiologically significant natural foci in Eastern Siberia and Mongolia: Diss. Irkutsk;2019.
- Колясникова Н.М., Ишмухаметов А.А., Акимкин В.Г. Современное состояние проблемы клещевого энцефалита в России и мире. Эпидемиология и вакцинопрофилактика. 2023;22(1):104–23. Kolyasnikova N.M., Ishmukhametov A.A., Akimkin V.G. The current state of the problem of tick-borne encephalitis in Russia and the world. Epidemiology and Vaccinal Prevention. 2023;22(1):104–23. DOI: https://doi.org/10.31631/2073-3046-2023-22-1-104-123 EDN: https://elibrary.ru/yeynhd
- Колясникова Н.М., Герасимов С.Г., Ишмухаметов А.А., Погодина В.В. Эволюция клещевого энцефалита за 80-летний период: основные проявления, вероятные причины. Эпидемиология и вакцинопрофилактика. 2020;19(3):78–88. Kolyasnikova N.M., Gerasimov S.G., Ishmukhametov A.A., Pogodina V.V. Evolution of tick-borne encephalitis over an 80-year period: main manifestations, probable causes. Epidemiology and Vaccinal Prevention. 2020;19(3):78–88. DOI: https://doi.org/10.31631/2073-3046-2020-19-3-78-88 EDN: https://elibrary.ru/kihhki
- Blom K., Cuapio A., Sandberg J.T., et al. Cell-mediated immune responses and immunopathogenesis of human tick-borne encephalitis virus-infection. Front. Immunol. 2018;9:2174. DOI: https://doi.org/10.3389/fimmu.2018.02174
- Bogovic P., Lotric-Furlan S., Strle F. What tick-borne encephalitis may look like: clinical signs and symptoms. Travel Med. Infect. Dis. 2010;8(4):246–50. DOI: https://doi.org/10.1016/j.tmaid.2010.05.011
- Bogovic P., Strle F. Tick-borne encephalitis: A review of epidemiology, clinical characteristics, and management. World J. Clin. Cases. 2015;3(5):430–41. DOI: https://doi.org/10.12998/wjcc.v3.i5.430
- Kubinski M., Beicht J., Gerlach T., et al. Tick-borne encephalitis virus: a quest for better vaccines against a virus on the rise. Vaccines (Basel). 2020;8(3):451. DOI: https://doi.org/10.3390/vaccines8030451
- Aberle J.H., Schwaiger J., Aberle S.W., et al. Human CD4 + T helper cell responses after tick-borne encephalitis vaccination and infection. PLoS One. 2015;10(10):e0140545. DOI: https://doi.org/10.1371/journal.pone.0140545
- Varnaitė R., Blom K., Lampen M.H., et al. Magnitude and functional profile of the human CD4+ T cell response throughout primary immunization with tick-borne encephalitis virus vaccine. J. Immunol. 2020;204(4):914–22. DOI: https://doi.org/10.4049/jimmunol.1901115
- Лучинина С.В., Семенов А.И., Степанова О.Н. и др. Вакцинопрофилактика клещевого энцефалита в Челябинской области: масштабы вакцинации, популяционный иммунитет, анализ случаев заболевания привитых. Эпидемиология и вакцинопрофилактика. 2016;15(1):67–76. Luchinina S.V., Semenov A.I., Stepanova O.N., et al. Vaccinal prevention of tick-borne encephalitis in Chelyabinsk region: dynamics of vaccination, population immunity, analysis of TBE cases in vaccinated persons. Epidemiology and Vaccinal Prevention. 2016;15(1):67–76. DOI: https://doi.org/10.31631/2073-3046-2016-15-1-67-76 EDN: https://elibrary.ru/vldhlb
- Погодина В.В., Щербинина М.C., Скрынник С.М. и др. Эпидемиологическая ситуация по клещевому энцефалиту и вакцинопрофилактика в Курганской области (1983–2017 гг.). Эпидемиология и вакцинопрофилактика. 2018;17(4):46–55. Pogodina V.V., Shcherbinina M.S., Skrynnik S.M., et al. Epidemiological situation of tick-borne encephalitis in the Kurgan region (1983–2017). Epidemiology and Vaccinal Prevention. 2018;17(4):46–55. DOI: https://doi.org/10.31631/2073-3046-2018-17-4-46-56 EDN: https://elibrary.ru/xxfrcx
- Козлова Т.Ю., Хантимирова Л.М., Рукавишников А.В., Шевцов В.А. Анализ эффективности и безопасности вакцин для профилактики клещевого энцефалита. БИОпрепараты. Профилактика, диагностика, лечение. 2018;18(1):33–41. Kozlova T.Yu., Khantimirova L.M., Rukavishnikov A.V., Shevtsov V.A. Analysis of efficacy and safety of tick-borne encephalitis vaccines. Biological Products. Prevention, Diagnosis, Treatment. 2018;18(1):33–41. DOI: https://doi.org/10.30895/2221-996X-2018-18-1-33-41
- Ackermann-Gäumann R., Lang P., Zens K.D. Defining the "Correlate(s) of Protection" to tick-borne encephalitis vaccination and infection – key points and outstanding questions. Front. Immunol. 2024;15:1352720. DOI: https://doi.org/10.3389/fimmu.2024.1352720
- Remoli M.E., Marchi A., Fortuna C., et al. Anti-tick-borne encephalitis (TBE) virus neutralizing antibodies dynamics in natural infections versus vaccination. Pathog. Dis. 2015;73(2):1–3. DOI: https://doi.org/10.1093/femspd/ftu002
- Dörrbecker B., Dobler G., Spiegel M., Hufert F.T. Tick-borne encephalitis virus and the immune response of the mammalian host. Travel Med. Infect. Dis. 2010;8(4):213–22. DOI: https://doi.org/10.1016/j.tmaid.2010.05.010
- Worku D.A. Tick-Borne Encephalitis (TBE): From tick to pathology. J. Clin. Med. 2023;12(21):6859. DOI: https://doi.org/10.3390/jcm12216859
- Aberle J.H., Stiasny K., Kundi M., Heinz F.X. Mechanistic insights into the impairment of memory B cells and antibody production in the elderly. Age (Dordr.). 2013;35(2):371–81. DOI: https://doi.org/10.1007/s11357-011-9371-9
- Lindquist L., Vapalahti O. Tick-borne encephalitis. Lancet. 2008;371(9627):1861–71. DOI: https://doi.org/10.1016/S0140-6736(08)60800-4
- Gritsun T.S., Lashkevich V.A., Gould E.A. Tick-borne encephalitis. Antiviral. Res. 2003;57(1-2):129–46. DOI: https://doi.org/10.1016/s0166-3542(02)00206-1
- Simmonds P., Becher P., Bukh J., et al. ICTV virus taxonomy profile: flaviviridae. J. Gen. Virol. 2017;98(1):2–3. DOI: https://doi.org/10.1099/jgv.0.000672
- Schwaiger J., Aberle J.H., Stiasny K., et al. Specificities of human CD4+ T cell responses to an inactivated flavivirus vaccine and infection: correlation with structure and epitope prediction. J. Virol. 2014;88(14):7828–42. DOI: https://doi.org/10.1128/JVI.00196-14
- Волкова Т.Д., Короев Д.О., Титова М.А. и др. Синтетические фрагменты белка ns1 вируса клещевого энцефалита, обладающие протективным действием. Биоорганическая химия. 2007;33(2):213–7. Volkova T.D., Koroev D.O., Titova M.A., et al. Synthetic fragments of the NS1 protein of the tick-borne encephalitis virus exhibiting a protective effect. Russian Journal of Bioorganic Chemistry. 2007;33(2):213–7. DOI: https://doi.org/10.1134/S1068162007020021 EDN: https://elibrary.ru/lkjlvr
- Garner-Spitzer E., Wagner A., Paulke-Korinek M., et al. Tick-borne encephalitis (TBE) and hepatitis B nonresponders feature different immunologic mechanisms in response to TBE and influenza vaccination with involvement of regulatory T and B cells and IL-10. J. Immunol. 2013;191(5):2426–36. DOI: https://doi.org/10.4049/jimmunol.1300293
- Lampen M.H., Uchtenhagen H., Blom K., et al. Breadth and dynamics of HLA-A2- and HLA-B7-Restricted CD8+ T cell responses against nonstructural viral proteins in acute human tick-borne encephalitis virus infection. Immunohorizons. 2018;2(6):172-84. DOI: https://doi.org/10.4049/immunohorizons.1800029
- Blom K., Braun M., Pakalniene J., et al. Specificity and dynamics of effector and memory CD8 T cell responses in human tick-borne encephalitis virus infection. PloS Pathog. 2015; 11(1):e1004622. DOI: https://doi.org/10.1371/journal.ppat.1004622
- Aregay A., Slunečko J., Bogovic P., et al. Poor virus-specific T-cell responses early after tick-borne encephalitis virus infection correlate with disease severity. Emerg. Microbes Infect. 2024;13(1):2317909. DOI: https://doi.org/10.1080/22221751.2024.2317909
- Růzek D., Salát J., Palus M., et al. CD8+ T-cells mediate immunopathology in tick-borne encephalitis. Virology. 2009;384(1):1–6. DOI: https://doi.org/10.1016/j.virol.2008.11.023
- Růžek D., Salát J., Singh S.K., Kopecký J. Breakdown of the blood-brain barrier during tick-borne encephalitis in mice is not dependent on CD8+ T-cells. PloS One. 2011;6(5):e20472. DOI: https://doi.org/10.1371/journal.pone.0020472
- Slon Campos J.L., Mongkolsapaya J., Screaton G.R. The immune response against flaviviruses. Nat. Immunol. 2018;19(11):1189–98. DOI: https://doi.org/10.1038/s41590-018-0210-3
- Sycheva A., Komech E., Pogorelyy M., et al. Inactivated tick-borne encephalitis vaccine elicits several overlapping waves of T cell response. Front. Immunol. 2022;13:970285. DOI: https://doi.org/10.3389/fimmu.2022.970285
- Gomez I., Marx F., Saurwein-Teissl M., et al. Characterization of tick-borne encephalitis virus-specific human T lymphocyte responses by stimulation with structural TBEV proteins expressed in a recombinant baculovirus. Viral Immunol. 2003;16(3):407–14. DOI: https://doi.org/10.1089/088282403322396190
- Salat J., Mikulasek K., Larralde O., et al. Tick-borne encephalitis virus vaccines contain non-structural protein 1 antigen and may elicit NS1-specific antibody responses in vaccinated individuals. Vaccines (Basel). 2020;8(1):81. DOI: https://doi.org/10.3390/vaccines8010081
- Hansson K.E., Rosdahl A., Insulander M., et al. Tick-borne encephalitis vaccine failures: a 10-year retrospective study supporting the rationale for adding an extra priming dose in individuals starting at age 50 years. Clin. Infect. Dis. 2020;70(2):245–51. DOI: https://doi.org/10.1093/cid/ciz176
- Šmit R., Postma M.J. Review of tick-borne encephalitis and vaccines: clinical and economical aspects. Expert Rev. Vaccines. 2015;14(5):737–47. DOI: https://doi.org/10.1586/14760584.2015.985661
- Воробьева М.С., Эльберт Л.Б., Грачев В.П. и др. Реактогенность и иммунологическая эффективность концентрированной очищенной вакцины против клещевого энцефалита. Вопросы вирусологии. 1983;28(5):622–6. Vorob'eva M.S., El'bert L.B., Grachev V.P., et al. Reactogenicity and immunological effectiveness of a concentrated, purified vaccine against tick-borne encephalitis. Problems of Virology. 1983;28(5):622–6.
- Ворович М.Ф., Майкова Г.Б., Чернохаева Л.Л. и др. Иммунологическая эффективность и безопасность вакцины «Клещ-Э-вак»: «взрослая» форма. Вопросы вирусологии. 2017;62(2):73–80. Vorovitch M.F., Maikova G.B., Chernokhaeva L.L., et al. Immunogenicity and safety of the adult TBE vaccine «Tick-E-Vac». Problems of Virology. 2017; 62(2):73–80. DOI: https://doi.org/10.18821/0507-4088-2017-62-2-73-80 EDN: https://elibrary.ru/yjkhft
- Yoshii K., Song J.Y., Park S.B., et al. Tick-borne encephalitis in Japan, Republic of Korea and China. Emerg. Microbes Infect. 2017;6(9):e82. DOI: https://doi.org/10.1038/emi.2017.69.
- Heinz F.X., Stiasny K., Holzmann H., et al. Vaccination and tick-borne encephalitis, central Europe. Emerg. Infect. Dis. 2013; 19(1):69–76. DOI: https://doi.org/10.3201/eid1901.120458
- Пеньевская Н.А., Рудаков Н.В., Рудакова С.А. Проблемные аспекты оценки эпидемиологической эффективности вакцинопрофилактики клещевого энцефалита. Эпидемиология и вакцинопрофилактика. 2018;17(5):78–88. Penyevskaya N.A., Rudakov N.V., Rudakova S.A. Problematic aspects of the evaluation of the epidemiological effectiveness of vaccination against tick-borne encephalitis. Epidemiology and Vaccinal Prevention. 2018;17(5):78–88. DOI: https://doi.org/10.31631/2073-3046-2018-17-5-78-88 EDN: https://elibrary.ru/yqxvdv
- Романенко В.В., Есюнина М.С., Килячина А.С., Пименова Т.А. Массовая иммунизация населения Свердловской области против клещевого энцефалита, ее эпидемиологическая, клиническая и иммунологическая эффективность вакцинопрофилактики. Медицинская вирусология. 2006;23:116–25. Romanenko V.V., Esyunina M.S., Kilyachina A.S., Pimenova T.A. Mass immunization Sverdlovsk region population against tickborne encephalitis, its epidemiological, clinical and immunological effectiveness of vaccination. Medical Virology. 2006;23:116–25.
- Романенко В.В., Есюнина М.С., Килячина А.С. Опыт реализации программы массовой иммунизации населения против клещевого энцефалита в Свердловской области. Вопросы вирусологии. 2007;52(6):22–5. Romanenko V.V., Yesyunina M.S., Kilyachina A.S. Experience in implementing the mass immunization program against tick-borne encephalitis in the Sverdlovsk Region. Problems of Virology. 2007;52(6):22–5. EDN: https://elibrary.ru/icdgcd
- Щербинина М.С., Бархалева О.А., Дорохова О.С., Мовсесянц А.А. Эффективность специфической профилактики клещевого энцефалита. БИОпрепараты. Профилактика, диагностика, лечение. 2020;20(3):174–86. Shcherbinina M.S., Barkhaleva O.A., Afonina O.S., Movsesyants A.A. Effectiveness of specific prevention of tick-borne encephalitis. Biological Products. Prevention, Diagnosis, Treatment. DOI: https://doi.org/10.30895/2221-996X-2020-20-3-174-186 EDN: https://elibrary.ru/xjyyhs
- Kuivanen S., Hepojoki J., Vene S., et al. Identification of linear human B-cell epitopes of tick-borne encephalitis virus. Virol. J. 2014;11:115. DOI: https://doi.org/10.1186/1743-422X-11-115
- Morozova O.V., Bakhvalova V.N., Potapova O.F., et al. Evaluation of immune response and protective effect of four vaccines against the tick-borne encephalitis virus. Vaccine. 2014;32(25):3101–6. DOI: https://doi.org/10.1016/j.vaccine.2014.02.046
- Vorovitch M.F., Grishina K.G., Volok V.P., et al. Evervac: phase I/II study of immunogenicity and safety of a new adjuvant-free TBE vaccine cultivated in Vero cell culture. Hum. Vaccin. Immunother. 2020;16(9):2123–30. DOI: https://doi.org/10.1080/21645515.2020.1757990
- Алпатова Н.А., Авдеева Ж.И., Гайдерова Л.А. и др. Иммунный ответ при иммунизации противовирусными вакцинами. БИОпрепараты. Профилактика, диагностика, лечение. 2020;20(1):21–9. Alpatova N.A., Avdeeva Zh.I., Gayderova L.A., et al. Immune response induced by immunisation with antiviral vaccines. Biological Products. Prevention, Diagnosis, Treatment. 2020;20(1):21–9. DOI: https://doi.org/10.30895/2221-996X-2020-20-1-21-29 EDN: https://elibrary.ru/tbqndr
- de Fabritus L., Nougairède A., Aubry F., et al. Attenuation of tick-borne encephalitis virus using large-scale random codon re-encoding. PLoS Pathog. 2015;11(3):e1004738. DOI: https://doi.org/10.1371/journal.ppat.1004738
- Kofler R.M., Heinz F.X., Mandl C.W. Capsid protein C of tick-borne encephalitis virus tolerates large internal deletions and is a favorable target for attenuation of virulence. J. Virol. 2002;76(7):3534–43. DOI: https://doi.org/10.1128/jvi.76.7.3534-3543.2002
- Mandl C.W., Allison S.L., Holzmann H., et al. Attenuation of tick-borne encephalitis virus by structure-based site-specific mutagenesis of a putative flavivirus receptor binding site. J. Virol. 2000;74(20):9601–9. DOI: https://doi.org/10.1128/jvi.74.20.9601-9609.2000
- Dutta S.K., Langenburg T. A perspective on current flavivirus vaccine development: a brief review. Viruses. 2023;15(4):860. DOI: https://doi.org/10.3390/v15040860
- Ershova A.S., Gra O.A., Lyaschuk A.M., et al. Recombinant domains III of Tick-Borne Encephalitis Virus envelope protein in combination with dextran and CpGs induce immune response and partial protectiveness against TBE virus infection in mice. BMC Infect. Dis. 2016;16(1):544. DOI: https://doi.org/10.1186/s12879-016-1884-5
- Zhang M., Jin H., Jiao C., et al. An effective tick-borne encephalitis virus vaccine candidate based on virus-like particles induced specific cellular and humoral immunity in mice. 2023. Preprint. DOI: https://doi.org/10.2139/ssrn.4528843
- Tang J., Fu M., Xu C., et al. Development of a novel virus-like particle-based vaccine for preventing tick-borne encephalitis virus infection. Virol. Sin. 2023;38(5):767–77. DOI: https://doi.org/10.1016/j.virs.2023.06.003
- Beicht J., Kubinski M., Zdora I., et al. Induction of humoral and cell-mediated immunity to the NS1 protein of TBEV with recombinant Influenza virus and MVA affords partial protection against lethal TBEV infection in mice. Front. Immunol. 2023;14:1177324. DOI: https://doi.org/10.3389/fimmu.2023.1177324
- Kubinski M., Beicht J., Zdora I., et al. A recombinant Modified Vaccinia virus Ankara expressing prME of tick-borne encephalitis virus affords mice full protection against TBEV infection. Front. Immunol. 2023;14:1182963. DOI: https://doi.org/10.3389/fimmu.2023.1182963
- Li A., Yu J., Lu M., et al. A Zika virus vaccine expressing premembrane-envelope-NS1 polyprotein. Nat. Commun. 2018; 9(1):3067. DOI: https://doi.org/10.1038/s41467-018-05276-4
- Nürnberger C., Bodmer B.S., Fiedler A.H., et al. A measles virus-based vaccine candidate mediates protection against Zika virus in an allogeneic mouse pregnancy model. J. Virol. 2019;93(3): e01485-18. DOI: https://doi.org/10.1128/JVI.01485-18
- Kisakov D.N., Kisakova L.A., Borgoyakova M.B., et al. Optimization of in vivo electroporation conditions and delivery of DNA vaccine encoding SARS-CoV-2 RBD using the determined protocol. Pharmaceutics. 2022;14(11):2259. DOI: https://doi.org/10.3390/pharmaceutics14112259.
- Li L., Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev. Vaccines. 2016;15(3):313–29. DOI: https://doi.org/10.1586/14760584.2016.1124762
- Aberle J.H., Aberle S.W., Kofler R.M., Mandl C.W. Humoral and cellular immune response to RNA immunization with flavivirus replicons derived from tick-borne encephalitis virus. J. Virol. 2005;79(24):15107-13. DOI: https://doi.org/10.1128/JVI.79.24.15107-15113.2005
- Kofler R.M., Aberle J.H., Aberle S.W., et al. Mimicking live flavivirus immunization with a noninfectious RNA vaccine. Proc. Natl Acad. Sci. USA. 2004;101(7):1951–6. DOI: https://doi.org/10.1073/pnas.0307145101
- Wollner C.J., Richner J.M. mRNA vaccines against flaviviruses. Vaccines (Basel). 2021; 9(2):148. DOI: https://doi.org/10.3390/vaccines9020148
- Omori-Urabe Y., Yoshii K., Ikawa-Yoshida A., et al. Needle-free jet injection of DNA and protein vaccine of the far-eastern subtype of tick-borne encephalitis virus induces protective immunity in mice. Microbiol. Immunol. 2011;55(12):893–7. DOI: https://doi.org/10.1111/j.1348-0421.2011.00389.x
- Aberle J.H., Aberle S.W., Allison S.L., et al. A DNA immunization model study with constructs expressing the tick-borne encephalitis virus envelope protein E in different physical forms. J. Immunol. 1999;163(12):6756–61.
- Korber B., Fischer W. T cell-based strategies for HIV-1 vaccines. Hum. Vaccin. Immunother. 2020;16(3):713–22. DOI: https://doi.org/10.1080/21645515.2019.1666957
- Vita R., Mahajan S., Overton J.A., et al. The Immune Epitope Database (IEDB): 2018 update. Nucleic Acids Res. 2019; 47(D1):D339-43. DOI: https://doi.org/10.1093/nar/gky1006
- Antonets D.V., Bazhan S.I. PolyCTLDesigner: a computational tool for constructing polyepitope T-cell antigens. BMC Res. Notes. 2013;6:407. DOI: https://doi.org/10.1186/1756-0500-6-407
- Ezzemani W., Windisch M.P., Altawalah H., et al. Design of a multi-epitope Zika virus vaccine candidate — an in-silico study. J. Biomol. Struct. Dyn. 2023;41(9):3762–71. DOI: https://doi.org/10.1080/07391102.2022.2055648
- Fadaka A.O., Sibuyi N.R.S., Martin D.R., et al. Immunoinformatics design of a novel epitope-based vaccine candidate against dengue virus. Sci. Rep. 2021;11(1):19707. DOI: https://doi.org/10.1038/s41598-021-99227-7
- Nguyen TL, Kim H. Immunoinformatics and computational approaches driven designing a novel vaccine candidate against Powassan virus. Sci. Rep. 2024;14(1):5999. DOI: https://doi.org/10.1038/s41598-024-56554-9
- Choi H., Kudchodkar S.B., Ho M., et al. A novel synthetic DNA vaccine elicits protective immune responses against Powassan virus. PLoS Negl. Trop. Dis. 2020;14(10):e0008788. DOI: https://doi.org/10.1371/journal.pntd.0008788
- Khan N.T., Zinnia M.A., Islam A.B.M.M.K. Modeling mRNA- based vaccine YFV.E1988 against yellow fever virus E-protein using immuno-informatics and reverse vaccinology approach. J. Biomol. Struct. Dyn. 2023;41(5):1617–38. DOI: https://doi.org/10.1080/07391102.2021.2024253
- Borgoyakova M.B., Volosnikova E.A., Ilyichev A.A., Karpenko L.I. Approaches to improve the immunogenicity of plasmid DNA-based vaccines against COVID-19. In: Population Genetics — From DNA to Evolutionary Biology. IntechOpen; 2023. DOI: https://doi.org/10.5772/intechopen.113945
- Боргоякова М.Б., Карпенко Л.И., Рудометов А.П. и др. Искусственный Т-клеточный иммуноген против COVID-19. Бюллетень экспериментальной биологии и медицины. 2023;175(6):767–72. Borgoyakova M.B., Karpenko L.I., Rudometov A.P., et al. Artificial COVID-19 T-cell immunogen. Bulletin of Experimental Biology and Medicine. DOI: https://doi.org/10.47056/0365-9615-2023-175-6-767-772 EDN: https://elibrary.ru/ccsroy
- Chakraborty A., Bayry J., Mukherjee S. Immunoinformatics approaches in designing vaccines against COVID-19. Methods Mol. Biol. 2023;2673:431–52. DOI: https://doi.org/10.1007/978-1-0716-3239-0_29
- Enayatkhani M., Hasaniazad M., Faezi S., et al. Reverse vaccinology approach to design a novel multi-epitope vaccine candidate against COVID-19: an in silico study. J. Biomol. Struct. Dyn. 2021;39(8):2857–72. DOI: https://doi.org/10.1080/07391102.2020.1756411
- Sarkar B., Ullah M.A., Johora F.T., et al. Immunoinformatics-guided designing of epitope-based subunit vaccines against the SARS Coronavirus-2 (SARS-CoV-2). Immunobiology. 2020;225(3):151955. DOI: https://doi.org/10.1016/j.imbio.2020.151955
- Karpenko L.I., Apartsin E.K., Dudko S.G., et al. Cationic polymers for the delivery of the Ebola DNA vaccine encoding artificial T-cell immunogen. Vaccines (Basel). 2020;8(4):718. DOI: https://doi.org/10.3390/vaccines8040718
- Alizadeh M., Amini-Khoei H., Tahmasebian S., et al. Designing a novel multi epitope vaccine against Ebola virus using reverse vaccinology approach. Sci. Rep. 2022;12(1):7757. DOI: https://doi.org/10.1038/s41598-022-11851-z
- Shankar U., Jain N., Mishra S.K., et al. Mining of Ebola virus genome for the construction of multi-epitope vaccine to combat its infection. J. Biomol. Struct. Dyn. 2022;40(11):4815–31. DOI: https://doi.org/10.1080/07391102.2021.1874529
- Albaqami F.F., Altharawi A., Althurwi H.N., et al. Computational modeling and evaluation of potential mRNA and peptide-based vaccine against Marburg Virus (MARV) to provide immune protection against hemorrhagic fever. Biomed. Res. Int. 2023;2023:5560605. DOI: https://doi.org/10.1155/2023/5560605
- Bazhan S.I., Antonets D.V., Starostina E.V., et al. In silico design of influenza A virus artificial epitope-based T-cell antigens and the evaluation of their immunogenicity in mice. J. Biomol. Struct. Dyn. 2022;40(7):3196-212. DOI: https://doi.org/10.1080/07391102.2020.1845978
- Mia M.M., Hasan M., Ahmed S., Rahman M.N. Insight into the first multi-epitope-based peptide subunit vaccine against avian influenza A virus (H5N6): An immunoinformatics approach. Infect. Genet. Evol. 2022;104:105355. DOI: https://doi.org/10.1016/j.meegid.2022.105355
- Sharma S., Kumari V., Kumbhar B.V., et al. Immunoinformatics approach for a novel multi-epitope subunit vaccine design against various subtypes of Influenza A virus. Immunobiology. 2021;226(2):152053. DOI: https://doi.org/10.1016/j.imbio.2021.152053
- Старостина Е.В., Шарабрин С.В., Рудометов А.П. и др. Иммунный ответ на ДНК- и мРНК-вакцины, кодирующие искусственные иммуногены вируса гриппа. Российский иммунологический журнал. 2022;25(3):321–6. Starostina E.V., Sharabrin S.V., Rudometov A.P., et al. Immune response against DNA- and mRNA vaccines encoding artificial influenza virus immunogens. Russian Journal of Immunology. 2022;25(3):321–6. DOI: https://doi.org/10.46235/1028-7221-1103-IRA EDN: https://elibrary.ru/yuzmag
- Stieh D.J., Barouch D.H., Comeaux C., et al. ASCENT/HVTN118/HPX2003 Study Team. Safety and immunogenicity of Ad26-vectored HIV vaccine with mosaic immunogens and a novel mosaic envelope protein in HIV-uninfected adults: A phase 1/2a study. J. Infect. Dis. 2023;227(8):939–50. DOI: https://doi.org/10.1093/infdis/jiac445
- Карпенко Л.И., Бажан С.И., Богрянцева М.П. и др. Комбинированная вакцина против ВИЧ-1 на основе искусственных полиэпитопных иммуногенов: результаты I фазы клинических испытаний. Биоорганическая химия. 2016;42(2):191–204. Karpenko L.I., Bazhan S.I., Bogryantseva M.P., et al. Results of phase I clinical trials of a combined vaccine HIV-1 based on synthetic polyepitope immunogens. Russian Journal of Bioorganic Chemistry. 2016;42(2):191–204. DOI: https://doi.org/10.7868/S0132342316020068 EDN: https://elibrary.ru/vlpwyv
- Кисаков Д.Н., Антонец Д.В., Шабурова Е.В. и др. ДНК-вакцина, кодирующая искусственный Т-клеточный полиэпитопный иммуноген вируса клещевого энцефалита. Бюллетень экспериментальной биологии и медицины. 2023;176(7):85–9. doi: 10.47056/0365-9615-2023-176-7-85-89 EDN: https://elibrary.ru/jlcmud Kisakov D.N., Antonets D.V., Shaburova E.V., et al. DNA vaccine encoding the artificial T-cell polyepitope immunogen of tick-borne encephalitis virus. Bull. Exp. Biol. Med. 2023;176(1):72–6. DOI: https://doi.org/10.1007/s10517-023-05970-4
Дополнительные файлы