Влияние Bacillus subtilis BS20 на физиологические и иммунные показатели мышей мутантной линии Muc2–/–
- Авторы: Морозова М.В.1, Коркина В.И.2, Макарова М.А.3, Литвинова Е.А.4
-
Учреждения:
- Научно-исследовательский институт нейронаук и медицины
- Сибирский федеральный научный центр агробиотехнологий
- Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
- Новосибирский государственный технический университет
- Выпуск: Том 101, № 2 (2024)
- Страницы: 208-216
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/16595
- DOI: https://doi.org/10.36233/0372-9311-441
- EDN: https://elibrary.ru/nhqzzi
- ID: 16595
Цитировать
Полный текст
Аннотация
Введение. Воспалительные заболевания кишечника (ВЗК) — распространённая патология, которая не поддаётся полному излечению и требует пожизненной терапии. Использование пробиотиков рассматривают как один из перспективных и щадящих терапевтических подходов лечения ВЗК. В отличие от Lactobacillus и Bifidobacterium, представляющих основу большинства классических пробиотиков, спорообразующие Bacillus spp. лучше сохраняют жизнеспособность в условиях желудочно-кишечного тракта и выживаемость в период хранения пищевых продуктов, могут быть модуляторами иммунитета.
Цель работы — изучить влияние спор бактерий B. subtilis BS20 на физиологические и иммунные показатели мышей мутантной линии Muc2–/–.
Материалы и методы. Самкам мышей Muc2–/– на протяжении 2 мес добавляли в корм споры B. subtilis BS20 в количестве 109 КОЕ. Анализ аминокислотного состава ткани бедренной мышцы выполняли методом капиллярного электрофореза. Концентрацию цитокинов в ткани толстой кишки изучали в мультиплексном анализе. Долю иммунных клеток в спленоцитах определяли методом проточной цитофлуориметрии.
Результаты. Добавление в корм спор B. subtilis BS20 способствовало увеличению продолжительности жизни и снижению потери массы тела у мышей-самок Muc2–/–. В биоптатах нисходящей ободочной кишки выявлено снижение уровня провоспалительного цитокина интерлейкина-6 и повышение уровня интерлейкина-17, в спленоцитах — увеличение количества В-клеток и Т-хелперов.
Заключение. B. subtilis BS20 улучшает общее состояние мышей мутантной линии Muc2–/–, оказывает противовоспалительное и иммуностимулирующее действие, снижая уровень цитокина интерлейкина-6 и повышая процент В-клеток и Т-хелперов в селезёнке.
Полный текст
Введение
Воспалительные заболевания кишечника (ВЗК) в настоящее время широко распространены, их ареал и число заболевших имеют тенденцию к росту. Если ранее ВЗК считались болезнью с наибольшей распространённостью в США и Европе, то в последнее десятилетие рост заболеваемости отмечен в странах Азии, включая Китай и Индию [1]. К ВЗК относят язвенный колит и болезнь Крона, для которых характерны хроническое воспаление и повреждение слизистой оболочки желудочно-кишечного тракта (ЖКТ). К причинам возникновения ВЗК относят генетическую предрасположенность, диету, экологию, курение, иммунный статус, кишечные инфекции бактериальной этиологии [2]. Эффективного лечения ВЗК, приводящего к полному излечению [3], не разработано, а существующие терапевтические подходы имеют побочные эффекты. Поскольку для купирования воспалительного процесса требуется длительный и неоднократный приём антибиотиков, то для снижения количества нежелательных последствий важно использовать поддерживающую терапию. Одним из терапевтических направлений является использование пробиотиков, пребиотиков, симбиотиков и метаболитов бактерий. Поиск препаратов для поддерживающей терапии ВЗК ведут среди классических пробиотических штаммов Lactobacillus и Bifidobacterium [4–7]. В то же время спорообразующие Bacillus spp. могут иметь преимущество, поскольку более устойчивы к кислой среде желудка и, являясь аллохтонными, легко элиминируются из организма после прекращения применения [8]. Пробиотики на основе штаммов Bacillus spp. эффективны при лечении ВЗК инфекционной и неинфекционной этиологии [9–13].
Мыши мутантной линии Muc2–/– имеют делецию гена Muc2, кодирующего протеогликан MUC2 (у мышей Muc2) — основной секреторный муцин бокаловидных клеток толстой кишки млекопитающих [2]. Белок Muc2 создаёт слизистый барьер, который защищает эпителиальный слой кишечника от бактерий. Недостаточность слизистого слоя способствует прямому контакту бактерий с энтероцитами, что приводит к их воспалению. Нарушение синтеза Muc2 в толстой кишке усиливает пролиферацию и уменьшает дифференцировку клеток, вызывает уплощение и изъязвление слоя эпителиальных клеток с потерей их архитектуры, что приводит к удлинению крипт, увеличению количества лейкоцитов и повышению проницаемости стенки кишки («синдром дырявого кишечника»). Данное патологическое состояние способствует развитию спонтанного колита, а впоследствии — колоректального рака [2]. Уменьшение синтеза Muc2 в кишечнике может приводить к изменению бактериального состава микробиоты [14]. Мыши Muc2–/– — это экспериментальная модель ВЗК, у которых на ранних этапах онтогенеза развиваются воспаление, диарея, пролапс кишки и гемоколит, снижается масса тела. В результате этого мыши склонны к гибели в более раннем возрасте, чем мыши с нормальной барьерной функцией кишки [15].
B. subtilis может повышать экспрессию протеогликана (MUC2), белков плотных контактов, оклюдина и противовоспалительных факторов, в результате чего сокращается потеря массы, сохраняется длина толстой кишки [11], а также способствует уменьшению воспаления, восстановлению слизистого барьера, индуцирует пролиферацию стволовых клеток кишечника, нормализует кишечную микробиоту [12, 13]. Добавление в рацион мышам Muс+/+ спор B. subtilis BS20 способствовало нормализации поведения мышей и повлияло на экспрессию цитокинов в кишечнике, концентрацию серотонина и тирозина в крови [16].
ВЗК является патологией со сложной этиологией, поэтому необходимы их разносторонние исследования. Данных о механизме действия Bacillus spp. как пробиотика, особенно при ВЗК, недостаточно. В связи с этим требуются дополнительные исследования штаммов Bacillus spp. на экспериментальных моделях ВЗК.
Целью данной работы было изучение влияния спор B. subtilis BS20 на физиологические и иммунные показатели мутантной линии мышей Muc2–/–. Для достижения цели были поставлены задачи: определить эффект добавления в корм мышам Muc2–/– штамма B. subtilis BS20 на продолжительность жизни, массу тела, иммунные показатели (цитокины и иммунные клетки в селезёнке) и аминокислотный состав мышц.
Материалы и методы
Работа была выполнена в Научно-исследовательском институте нейронаук и медицины (НИИНМ). В эксперимент были отобраны 9 6-месячных самок мышей Muc2−/− в опытную группу и 6 в контрольную [17]. В качестве контроля при изучении уровня цитокинов были взяты 3 самки мышей линии C57BL/6. Животные содержались в открытых клетках при температуре 22–24ºC и инвертированном световом режиме 12:12 ч. Доступ к воде и корму был свободным. В корм опытной группы на протяжении 2 мес добавляли суспензию спор штамма B. subtilis BS20 из коллекции бактериальных штаммов лаборатории НИИНМ в количестве 109 спор/г корма. Экспериментальные исследования проводили в соответствии с законодательством Российской Федерации и стандартами Надлежащей лабораторной практики (приказ Минздрава России от 19.06.2003 № 267), руководствами комитета Научно-исследовательского института нейронаук и медицины по биоэтике (протокол № 3 от 19.05.2022), и Европейской конвенции по защите позвоночных животных. Используемые в работе мыши Muc2−/− и C57BL/6 имели SPF-статус (specific pathogen free — без видоспецифических патогенных микроорганизмов), который указан в рекомендациях Европейской федерации сотрудников, работающих с лабораторными животными, FELASA 2014 [18]. Статус здоровья мышей каждой линии подтверждали согласно рекомендациям FELASA 2014 [18].
Бактериальный штамм и условия роста
Культивирование на селективной среде с добавлением антибиотика канамицина обеспечивает рост выбранного штамма B. subtilis BS20 [16] и способствует точному подсчёту КОЕ в помёте мышей после прохождения через ЖКТ. Выросшие колонии пересевали на казеин-пептонный агар с дексторозой (DCPA, «Merck») и инкубировали при +37ºС в течение 72–96 ч до перехода всех микробных клеток в споровую форму. Споры бактерий ресуспендировали в стерильном фосфатно-солевом буфере (ФСБ) и добавляли в корм в количестве 109 КОЕ [19].
Анализ количества спор Bacillus subtilis BS20 в корме и помете мышей
Десять грамм корма гомогенизировали в 90 мл ФСБ, 100 мг помета мышей — в 0,9 мл ФСБ с последующим десятикратным серийным разведением для каждой пробы. Удаление вегетативных форм B. subtilis BS20 проводили нагреванием в течение 15 мин при 85ºС. Для подсчёта количества спор использовали аликвоты каждого разведения в объёме 500 мкл. Посев производили на DCPA, инкубировали в аэробных условиях при 36ºС в течение 48 ч. Выживаемость спор в корме оценивали спустя 1 мес хранения. В помёте мышей количество спор определяли через 2 нед от начала эксперимента и через 1 мес после добавления спор в корм.
Определение уровня цитокинов
Для измерения уровня цитокинов биоптат нисходящего отдела толстой кишки гомогенизировали в жидком азоте. После добавления 100 мкл ФСБ образец центрифугировали при 12 000 об/мин в течение 15 мин при 4ºC. Концентрацию цитокинов измеряли при помощи набора для мультиплексного анализа «Cloud-Clone» в соответствии с рекомендациями производителя. Детекцию цитокинов проводили на приборе «Luminex 200» («Merck») с xPONENT 3.1. программным обеспечением. Концентрацию цитокинов нормализовали к общему белку, который измеряли по Бредфорду и представляли в виде пг цитокина на 1 мг общего белка.
Определение доли спленоцитов
Биоптат селезёнки гомогенизировали при помощи пестикового ручного гомогенизатора («Sovtech»). Полученную суспензию клеток пропускали через фильтр с диаметром пор 70 мкм («BD Falcon»). Определение количества CD25+Foxp3+СD4+-клеток проводили методом проточной цитометрии. Для окрашивания клеток 250 мкл суспензии инкубировали с антителами с FITC-anti-CD4, PE-anti-CD3ε, PE/Cy7-anti-CD8a and PE-anti-CD3ε, Pacific blue-anti-CD45, FITC-anti-CD19 и APC anti-CD25 («BioLegend») 30 мин при +4ºС. Разбавляли клетки 100 мкл буфера для пермобилизации TrueNuclear Perm («BioLegend») и инкубировали с антителами AlexaFluor488 anti-Foxp3 («BioLegend») 60 мин в темноте при комнатной температуре. После промывки клетки разбавляли буфером для окрашивания до концентрации 1500–3000 клеток/мкл и инкубировали без света при температуре 4ºС до анализа (1–2 дня) на проточном цитофлуориметре «BD FACSCanto II Flow Cytometer» («BD Biosciences»). В каждом образце анализировали 50 000 лимфоцитов. В спленоцитах выделяли одиночные клетки (синглеты) и одиночные CD4+-лимфоциты. Для анализа вычисляли процент CD45+CD3+-Т-клеток, CD45+CD3+CD4+-Т-хелперов, CD45+CD3+CD8+-Т-киллеров, CD45+CD19+-В-клеток, CD4+CD25+Foxp3+-регуляторных Т-клеток и CD4+CD25–Foxp3+-эффекторных Т-клеток.
Определение cодежания аминокислот в составе белка бедренной мыщцы
Капиллярный электрофорез выполняли на установке «КАПЕЛЬ-105М» («Люмэкс») с ультрафиолетовым детектором. От каждой мыши брали по два 100 мг образца бедренной мышцы. Пробы анализировали с помощью картриджа с кварцевыми капиллярами длиной 75 см и внутренним диаметром 50 мкм («Люмэкс»). Определение содержания аргинина, лизина, тирозина, фенилаланина, гистидина, суммы лейцина и изолейцина, метионина, валина, пролина, треонина, серина, аланина и глицина проводили в фенилизотиоцианате производных аминокислот. Массовую долю триптофана определяли в жидкой фракции напрямую без получения производных фенилизотиоцианата. Обнаружение проводили при длине волны 219, давлении 30 мбар, напряжении +25 кВ. Внешний стандарт — коммерческая стандартная смесь аминокислот (LAA21-1KT, «Sigma Aldrich»). Анализ данных выполняли с помощью программного обеспечения «Эльфоран» («Люмэкс») [20].
Статистический анализ
Данные представлены в виде средних ± SEM для количественных значений и в долях (%) — для качественных. Распределение выявляли с помощью описательной статистики в «Statistica v. 10.0» с использованием теста Колмогорова–Смирнова. Данные с ненормальным распределением оценивали с помощью U-критерия Манна–Уитни для независимых групп. Для категориальных переменных использовали точный тест Фишера. Значение p < 0,05 считали значимым.
Результаты
Для определения жизнеспособности спор B. subtilis BS20 при прохождении через пищеварительный тракт исследовали количество жизнеспособных спор в содержимом кишечника самок Muc2–/– и в корме через 1 мес от начала добавления в рацион животных. Количество жизнеспособных спор B. subtilis BS20 во всех образцах помета мышей составило 107 КОЕ/г, в корме — в 109 КОЕ/г.
Хроническое воспаление кишечника у мышей Muc2–/– приводит к потере массы и гибели к возрасту 5–8 мес более 40% животных. В проведённом эксперименте к 8 мес выжили все мыши, получавшие с кормом B. subtilis BS20. В контрольной группе к 8 мес живыми осталось 55% (5 из 9) особей. Статистическая достоверность полученных результатов находилась на уровне тенденции (p = 0,09, точный тест Фишера), однако это следствие малого объёма выборки. Основными причинами падежа лабораторных животных в контрольной группе были пролапс кишки и заметная потеря массы тела.
Потеря массы тела мышей к 8 мес была значимо больше в контрольной группе (р < 0,05; Z = –2,28; р < 0,01, U-тест Манна–Уитни).
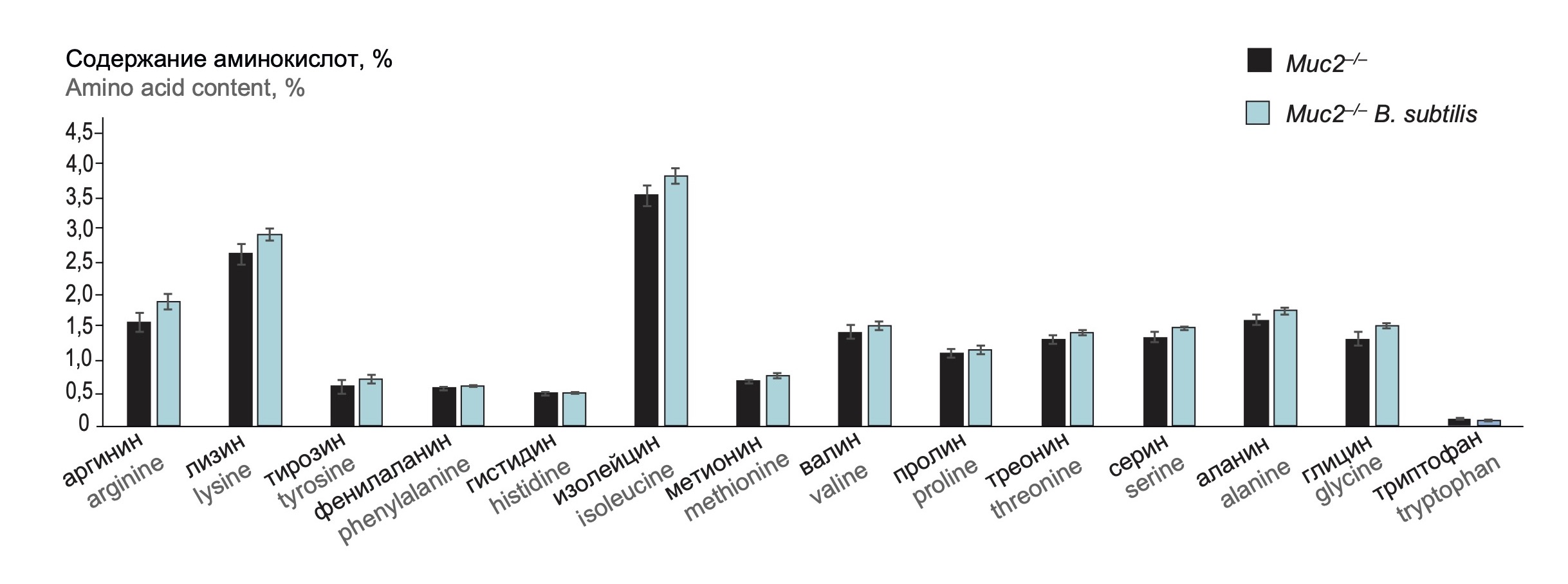
Достоверных различий в содержании 24 аминокислот (аргинин, лизин, тирозин, фенилаланин, гистидин, изолейцин, метионин, валин, пролин, треонин, серин, аланин, глицин, триптофан) в сравниваемых группах не выявлено (рис. 1).
Рис. 1. Влияние добавления в корм спор B. subtilis BS20 на состав аминокислот в мышечной ткани бедра мышей Muc2–/– (n = 5) and Muc2–/– B. subtilis (n = 6).
Fig. 1. Effect of adding of B. subtilis BS20 spores to food on the composition of amino acids in the femoral muscle tissue of Muc2–/– mice (n = 5) and Muc2–/– B. subtilis mice (n = 6).
У самок мышей Muc2–/–, содержащихся на обычном корме, в нисходящей ободочной кишке наблюдалось развитие воспаления и изменения профиля и уровней цитокинов интерферона-γ (ИФН-γ), интерлейкинов (ИЛ) 1b, 4, 6, 10, 13 по сравнению с показателями мышей линии С57BL/6 (р < 0,05; Z = –2,23; рис. 2, а).
Рис. 2. Влияние спор B. subtilis BS20 на уровень цитокинов в толстой кишке (а) и долю иммунных клеток селезёнки (б) мышей Muc2–/– в возрасте 8 мес. *p < 0,05, U-тест Манна–Уитни.
Fig. 2. Effect of of B. subtilis BS20 spores on the level of cytokine in colon (а) and percentage of the immune cells in spleen (b) of Muc2–/– mice at 8 months. *p < 0.05, Mann–Whitney U test.
Анализ уровня ИЛ-1a, 5, 12, 12B, 15, 17, 7, 2 не выявил различий между мутантами и мышами дикого типа (рис. 2, а). В группе мышей Muc2–/–, получавшей с кормом споры B. subtilis BS20, отмечено снижение уровня ИЛ-6 и повышение значений ИЛ-17 по сравнению с мышами Muc2–/–, находящихся на корме без добавок (р < 0,05). Уровни ИФН-γ, ИЛ-1a, 1b, 4, 5, 10, 12, 12B, 13, 15, 7, 2 сохранялись на прежних уровнях по сравнению с мутантами, содержащимися на обычном корме (р > 0,05).
В результате добавления в корм спор B. subtilis BS20 у Muc2–/– отмечено достоверно значимое увеличение доли B-клеток (CD45+CD19+) и Т-хелперов (CD45+CD3+CD4+); р < 0,05 (рис. 2, б). Статистически значимых различий в количестве других лимфоцитов: Т-клетки (СD45+CD3+), T-киллеры (СD45+CD3+CD8+), регуляторные (СD45+CD3+CD4+CD25+FoxP3+) и эффекторные (СD45+CD3+CD4+CD25+FoxP3–) Т-клетки после кормления спорами бактерий не выявлено.
Обсуждение
Пробиотики широко используют в терапии заболеваний ЖКТ. Они рассматриваются не только как средства коррекции кишечного дисбиоза, но и как перспективные инструменты иммуномодуляции. В отличие от неспороформирующих пробиотических штаммов Lactobacilllus и Bifidobacterium, спорообразующие Bacillus spp. лучше сохраняют жизнеспособность в условиях ЖКТ и выживаемость в период хранения пищевых продуктов [8].
В результате проведённого нами исследования установлено, что штамм B. subtilis BS20 характеризуется достаточным пробиотическим эффектом [11], т. к. при прохождении через кислую среду желудка и все отделы кишечника мышей он сохранял стабильность, жизнеспособность и выживаемость в количестве 107 КОЕ, а в корме при хранении при комнатной температуре в течение месяца — 109 КОЕ.
Эффективность пробиотиков на основе бактерий Bacillus spp. неоднократно изучалась на различных моделях инфекционных и неинфекционных воспалительных заболеваний ЖКТ [9, 11–13]. В данном эксперименте установлено, что добавление в течение 2 мес спор штамма B. subtilis BS20 в корм мышам мутантной линии Muc2–/–, используемой в качестве экспериментальной модели ВЗК, стабилизировало массу тела (по сравнению с массой тела мутантов, не употреблявших пробиотики, которая была ниже на 10%), обеспечивало 100% выживаемость к возрасту 8 мес и увеличивало продолжительность жизни на 30%. Аналогичные результаты были получены при исследовании влияния B. subtilis на мышах инбредной линии BALB/c, чувствительных к желудочно-кишечным инфекциям [21].
Бактерии рода Bacillus способны активно продуцировать ряд ферментов, расщепляющих крахмал, целлюлозу, белки, жиры [9, 20], что может облегчать пищеварение и усвоение питательных веществ. В проведённом исследовании изменений в процентном содержании аминокислот в мышце бедра опытных мышей не обнаружено. Полученные результаты позволили предположить, что добавление в корм штамма B. subtilis BS20 не оказывает влияния на усвоение аминокислот.
Отсутствие нормальной слизистой оболочки у мышей Muc2–/– приводит к развитию воспаления, симптоматика которого схожа с таковой у пациентов с язвенным колитом. Основными цитокинами, увеличение которых наблюдается при ВЗК у пациентов, являются фактор некроза опухоли-α (ФНО-α), ИЛ-1b и -6. В.Д. Бец и соавт. [15] показали, что в сравнении с мышами C57BL/6 у линии Muc2–/– увеличена экспрессия цитокинов ИФН-γ, ИЛ-1b, 4, 6, 10, 13, что подтверждает наличие у них хронического воспалительного процесса. В результате использования корма с добавлением спор B. subtilis BS20 у мышей Muc2–/– выявлено снижение уровня ИЛ-6 и повышение уровня ИЛ-17, что свидетельствовало о противовоспалительной активности штамма. В исследованиях D. Liu и соавт. на крысах на высокожировой диете показано, что добавление спор B. subtilis приводило к снижению уровня ИЛ-6, ФНО-α и ИЛ-17 [22]. В работах G. Yi и соавт. установлено, что добавление B. subtilis в рацион мышам с химически индуцированным колитом способствовало снижению экспрессии ФНО-α, ИЛ-6, 17 и 23 [21]. Известно, что широко используемый в качестве пробиотика штамм B. subtilis DE111, в отличие от штамма B. subtilis BS20, не влияет на маркеры кишечного воспаления (ИЛ-6, секреторный иммуноглобулин A) [23].
В последние годы большое внимание привлекает цитокин ИЛ-17, продуцируемый преимущественно Т-хелперами, стимулирующий гранулоцитопоэз и способствующий усилению антителозависимой гибели опухолевых клеток. Введение ИЛ-17 мышам, чувствительным к аутоиммунному увеиту (воспаление структур сосудистой оболочки глаза), оказывало противовоспалительное действие [24]. В то же время известно, что ИЛ-17 может усугублять развитие воспаления и способствовать уменьшению числа Т-хелперов.
Изначально экспериментальная модель Muc2–/– была создана для изучения колоректального рака. Начиная с 6-го месяца жизни у мышей этой линии формируются аденокарциномы по всей длине кишечника, к 1 году опухоли образуются у 100% особей [2]. В результате проведённого исследования показано, что после добавления B. subtilis BS20 в корм мышам Muc2–/– увеличилось количество ИЛ-17 в сочетании с экспрессией Т-хелперов, что можно рассматривать как фактор снижения риска развития рака толстой кишки.
Селезёнка, являясь крупнейшим вторичным лимфоидным органом, отражает базовое состояние периферической иммунной системы. Выявленное повышение процента В-клеток и Т-хелперов в селезёнке в сочетании с повышением уровня ИЛ-17 у мышей, получавших с кормом споры B. subtilis BS20, свидетельствует об улучшении адаптационной реакции иммунной системы и переключении на антителообразование [25]. Поскольку у мышей Muc2–/– отсутствует муциновая выстилка в кишечнике, соотношение и состав микробиоты у них меняется [17], кроме того, отсутствие муцинового барьера делает слизистую кишечника беззащитной перед патогенными и условно-патогенными микроорганизмами. Поскольку штамм B. subtilis BS20 стимулирует гуморальное звено иммунитета у мышей Muc2–/–, возможно, это способствует развитию у них устойчивости к патогенным микроорганизмам и объясняет увеличение массы тела и продолжительности жизни. В предыдущих исследованиях показано, что мыши Muc2–/– при кормлении неавтоклавированным кормом, содержащим несколько видов представителей рода Bacillus, характеризовались лучшим репродуктивным индексом, более поздним появлением пролапса прямой кишки и высоким содержанием Т-хелперов в селезёнке, по сравнению с физиологическими и иммунологическими показателями мышей, получавших автоклавированный корм, содержащий инактивированные споры бактерий [26]. Добавление в корм штамма B. subtilis DE111 способствует увеличению уровня регуляторных Т-клеток и Т-хелперов, наряду со снижением содержания Т-киллеров [23].
Заключение
Штаммы B. subtilis и их метаболиты являются непатогенными для человека, что позволяет считать их наиболее перспективными в качестве основы пробиотиков нового поколения. Большинство известных штаммов B. subtilis проявили себя как средство с многогранной клинической эффективностью и в настоящее время рекомендованы в схемах терапии при лечении пациентов с дисбиозом кишечника различного генеза, хроническими заболеваниями пищеварительного тракта, после перенесённых острых кишечных инфекций, на фоне и после приёма антибиотиков, после проведения химиотерапии, на фоне длительной гормональной терапии, в условиях хронических стрессовых состояний, при нерациональной диетотерапии. Препараты на основе B. subtilis снижают выраженность диспептических расстройств, улучшают кишечное пищеварение, эффективно оказывают иммуномодулирующее действие и способствуют повышению качества жизни. С учётом того, что пробиотики, содержащие B. subtilis, не имеют противопоказаний и не вызывают побочных эффектов, сфера их применения постоянно расширяется [27, 28].
Таким образом, в научных работах последних десятилетий было сделано значительное продвижение в изучении спектра активности B. subtilis, в то же время для оценки терапевтической эффективности при ВЗК необходимы более длительные эксперименты.
Выводы
Таким образом, споры B. subtilis BS20 оказывают не только противовоспалительное действие в кишечнике мышей Muc2–/–, подтверждающееся снижением уровня провоспалительного цитокина ИЛ-6, но и выступают как стимулирующее гуморальное звено иммунитета, повышая в селезёнке содержание В-клеток и Т-хелперов. Добавление спор бактерий в корм без изменений усвоения белков способствует увеличению продолжительности жизни, препятствуя потере массы тела у половозрелых самок Muc2–/– мутантной линии мышей, являющихся экспериментальной моделью ВЗК.
Об авторах
Марьяна Владимировна Морозова
Научно-исследовательский институт нейронаук и медицины
Автор, ответственный за переписку.
Email: morozova.maryana@mail.ru
ORCID iD: 0000-0003-3749-5214
Scopus Author ID: 36055253900
к.б.н., с.н.с. лаб. экспериментальных моделей нейропсихиатрических нарушений
Россия, НовосибирскВалентина Игоревна Коркина
Сибирский федеральный научный центр агробиотехнологий
Email: morozova.maryana@mail.ru
ORCID iD: 0000-0002-9472-5787
к.б.н., с.н.с. лаб. биохимии
Россия, пос. КраснообскМария Александровна Макарова
Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Email: morozova.maryana@mail.ru
ORCID iD: 0000-0003-3600-2377
д.м.н., в.н.с., зав. лаб. кишечных инфекций
Россия, Санкт-ПетербургЕкатерина Анатольевна Литвинова
Новосибирский государственный технический университет
Email: morozova.maryana@mail.ru
ORCID iD: 0000-0001-6398-7154
к.б.н., н.с., руководитель
Россия, НовосибирскСписок литературы
- Mak W.Y., Zhao M., Ng S.C., Burisch J. The epidemiology of inflammatory bowel disease: East meets west. J. Gastroenterol. Hepatol. 2020;35(3):380–9. doi: https://doi.org/10.1111/JGH.14872
- Милутинович К.С., Попов В.С. Muc2-дефицитные мыши как модель хронического воспаления. Лабораторные животные для научных исследований. 2023;(3):118–26. Milutinovich K.S., Popov V.S. Muc2-deficient mice as a model of chronic inflammation. Laboratory Animals for Science. 2023;(3):118–26. doi: https://doi.org/10.57034/2618723X-2023-03-11 doi: https://elibrary.ru/pipxjk
- Маев И.В., Шелыгин Ю.А., Скалинская М.И. и др. Патоморфоз воспалительных заболеваний кишечника. Вестник Российской академии медицинских наук. 2020;75(1):27–35. Maev I.V., Shelygin Yu.A., Skalinskaya M.I., et al. The pathomorphosis of inflammatory bowel diseases. Annals of the Russian Academy of Medical Sciences. 2020;75(1):27–35. doi: https://doi.org/10.15690/vramn1219 EDN: https://elibrary.ru/fwjiao
- Ma X., Shin Y.J., Jang H.M., et al. Lactobacillus rhamnosus and Bifidobacterium longum alleviate colitis and cognitive impairment in mice by regulating IFN-γ to IL-10 and TNF-α to IL-10 expression ratios. Sci. Rep. 2021;11(1):20659. doi: https://doi.org/10.1038/s41598-021-00096-x
- Leccese G., Bibi A., Mazza S., et al. Probiotic Lactobacillus and Bifidobacterium strains counteract adherent-invasive Escherichia coli (AIEC) virulence and hamper IL-23/Th17 axis in ulcerative colitis, but not in Crohn’s disease. Cells. 2020;9(8):1824. doi: https://doi.org/10.3390/cells9081824
- Wang T., Zhang L., Wang P., et al. Lactobacillus coryniformis MXJ32 administration ameliorates azoxymethane/dextran sulfate sodium-induced colitis-associated colorectal cancer via reshaping intestinal microenvironment and alleviating inflammatory response. Eur. J. Nutr. 2022;61(1):85–99. doi: https://doi.org/10.1007/s00394-021-02627-8
- Hrdý J., Alard J., Couturier-Maillard A., et al. Lactobacillus reuteri 5454 and Bifidobacterium animalis ssp. lactis 5764 improve colitis while differentially impacting dendritic cells maturation and antimicrobial responses. Sci. Rep. 2020;10(1):5345. doi: https://doi.org/10.1038/s41598-020-62161-1
- Soares M.B., Martinez R.C.R., Pereira E.P.R., et al. The resistance of Bacillus, Bifidobacterium, and Lactobacillus strains with claimed probiotic properties in different food matrices exposed to simulated gastrointestinal tract conditions. Food Res. Int. 2019;125:108542. doi: https://doi.org/10.1016/j.foodres.2019.108542
- Suva M.A., Sureja V.P., Kheni D.B. Novel insight on probiotic Bacillus subtilis: mechanism of action and clinical applications. J. Curr. Res. Sci. Med. 2016;2(2):65–72. doi: https://doi.org/10.4103/2455-3069.198381
- Червинец В.Ю., Червинец М.В., Ганзя Д.В. Применение пробиотиков в лечении дисбактериоза пищеварительного тракта. Экспериментальная и клиническая гастроэнтерология. 2022;(4):94–100. Chervinets V.Yu., Chervinets M.V., Ganzya D.V. Application of probiotics in treatment of digestive tract dysbacteriosis. Experimental and Clinical Gastroenterology Journal. 2022;(4):94–100. doi: https://doi.org/10.31146/1682-8658-ecg-200-4-94-100 EDN: https://elibrary.ru/oasmfq
- Li Y., Zhang T., Guo C., et al. Bacillus subtilis RZ001 improves intestinal integrity and alleviates colitis by inhibiting the Notch signalling pathway and activating ATOH-1. Pathog. Dis. 2020;78(2):ftaa016. doi: https://doi.org/10.1093/femspd/ftaa016
- Luo R., Zhang J., Zhang X., et al. Bacillus subtilis HH2 ameliorates TNBS-induced colitis by modulating gut microbiota composition and improving intestinal barrier function in rabbit model. J. Funct. Foods. 2020;74:104167. doi: https://doi.org/10.1016/j.jff.2020.104167
- Zhang X., Tong Y., Lyu X., et al. Prevention and alleviation of dextran sulfate sodium salt-induced inflammatory bowel disease in mice with Bacillus subtilis-fermented milk via inhibition of the inflammatory responses and regulation of the intestinal flora. Front. Microbiol. 2021;11:622354. doi: https://doi.org/10.3389/fmicb.2020.622354
- Wu M., Wu Y., Li J., et al. The dynamic changes of gut microbiota in Muc2 deficient mice. Int. J. Mol. Sci. 2018;19(9):2809. doi: https://doi.org/10.3390/ijms19092809
- Бец В.Д., Ачасова К.М., Борисова М.А. и др. Роль гликопротеина муцин и L-фукозы во взаимодействии иммунитета и микрофлоры на примере экспериментальной модели воспалительных заболеваний кишечника. Биохимия. 2022;87(3):356–75. Bets V.D., Achasova K.M., Borisova M.A., et al. The role of glycoprotein mucin 2 and L-fucose in the interaction of immunity and microflora of experimental model of inflammatory bowel diseases. Biochemistry (Moscow). 2022;87(3):356–75. doi: https://doi.org/10.31857/s0320972522030046 EDN: https://elibrary.ru/caqkhs
- Morozova M., Alekseev A., Saeidi A., Litvinova E. Normalization of deviant behavior in Muc2+/+ mice through dietary incorporation of Bacillus subtilis spores. Prog. Microbes Mol. Biol. 2023;6(1). doi: https://doi.org/10.36877/pmmb.A0000386
- Morozova M.V., Borisova M.A., Snytnikova O.A., et al. Colitis-associated intestinal microbiota regulates brain glycine and host behavior in mice. Sci. Rep. 2022;12(1):1–18. doi: https://doi.org/10.1038/s41598-022-19219-z
- Mähler С.M., Berar M., Feinstein R., et al. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units. Lab. Anim. 2014;48(3):178–92. doi: https://doi.org/10.1177/0023677213516312
- Samokhin A., Korel A., Blinova E., et al. Delivery of B. subtilis into animal intestine using chitosan-derived bioresorbable gel carrier: preliminary results. Gels. 2023;9(2):120. doi: https://doi.org/10.3390/gels9020120
- Морозова М.В., Калмыкова Г.В., Акулова Н.И., Литвинова Е.А. Определение содержания бактерий рода Bacillus в корме и фекалиях лабораторных мышей при содержании в стерильных и нестерильных условиях. Лабораторные животные для научных исследований. 2021;(3):11–6. Morozova M.V., Kalmykova G.V., Akulova N.I., Litvinova E.A. Analysis of Bacillus spp. in the diet and feces of laboratory mice under barrier-housing and non-sterile conditions. Laboratory Animals for Science. 2021;(3):11–6. doi: https://doi.org/10.29296/2618723X-2021-03-02 EDN: https://elibrary.ru/ybolke
- Gong Y., Li H., Li Y. Effects of Bacillus subtilis on epithelial tight junctions of mice with inflammatory bowel disease. J. Interferon Cytokine Res. 2016;36(2):75–85. doi: https://doi.org/10.1089/jir.2015.0030
- Liu D., Chen P. Binary Bacillus subtilis protects the intestinal mucosa barrier and alleviates nonalcoholic steatohepatitis. Anim. Model Exp. Med. 2023. doi: https://doi.org/10.1002/ame2.12337
- Freedman K.E., Hill J.L., Wei Y., et al. Examining the gastrointestinal and immunomodulatory effects of the novel probiotic Bacillus subtilis DE111. Int. J. Mol. Sci. 2021;22(5):2453. doi: https://doi.org/10.3390/ijms22052453
- Ke Y., Liu K., Huang G.Q., et al. Anti-inflammatory role of IL-17 in experimental autoimmune uveitis. J. Immunol. 2009;182(5):3183–90. doi: https://doi.org/10.4049/jimmunol.0802487
- Ishak N.I.M., Mohamed S., Madzuki I.N., et al. Limonin modulated immune and inflammatory responses to suppress colorectal adenocarcinoma in mice model. Naunyn Schmiedebergs Arch. Pharmacol. 2021;394(9):1907–15. doi: https://doi.org/10.1007/s00210-021-02101-6
- Morozova M.V., Kalmykova G.V., Akulova N.I., et al. Autoclaved diet with inactivated spores of Bacillus spp. decreased reproductive performance of Muc2−/− and Muc2+/− mice. Animals (Basel). 2022;12(18):2399. doi: https://doi.org/10.3390/ani12182399/S1
- Esparza-Gonzalez S.C., Troy A.R., Izzo A.A. Comparative analysis of Bacillus subtilis spores and monophosphoryl lipid A as adjuvants of protein-based Mycobacterium tuberculosis-based vaccines: Partial requirement for interleukin-17A for induction of protective immunity. Clin. Vaccine Immunol. 2014;21(4):501–8. doi: https://doi.org/10.1128/cvi.00622-13
- Lee J.E., Kye Y.C., Park S.M., et al. Bacillus subtilis spores as adjuvants against avian influenza H9N2 induce antigen-specific antibody and T cell responses in White Leghorn chickens. Vet. Res. 2020;51(1):68. doi: https://doi.org/10.1186/s13567-020-00788-8
Дополнительные файлы