The cell cultures in virology: from the past to the future
- Authors: Kuznetsova T.A.1, Besednova N.N.1, Aliev M.R.1, Shchelkanov M.Y.1
-
Affiliations:
- G.Р. Somov Institute of Epidemiology and Microbiology of Rospotrebnadzor
- Issue: Vol 101, No 1 (2024)
- Pages: 143-153
- Section: REVIEWS
- URL: https://microbiol.crie.ru/jour/article/view/16566
- DOI: https://doi.org/10.36233/0372-9311-421
- EDN: https://elibrary.ru/xsaecy
- ID: 16566
Cite item
Full Text
Abstract
The aim of the review is to give a brief characteristic of cell cultures obtained from mammalian tissues and to consider the current possibilities and prospects for their use in virology.
The analysis of the literature data presented in the main databases, such as Web of Science, PubMed, Scopus, Elsevier, Google Scholar and RSCI (as of July 2023), indicates that various types of cell cultures are currently used in virological studies. The use of cell culture has a number of advantages over other in vitro and in vivo methods of virological research. The review provides numerous examples on the development of new methods of obtaining cell cultures for the cultivation of viruses. Among them are sensitive and reporter cell systems, the design of which can be a promising tool for diagnostics of existing and new unknown viral infections. Cell cultures are characterized as potential in vitro models in virology for developing new diagnostic test-systems and antiviral drugs. An important area of cell cultures application is their use as a substrate for the production of culture-derived vaccines. Another aspect of the cell cultures application is also highlighted, such as the study of the effect of the viruses on the host immune system or the mechanisms of immunopathogenesis of viral infections. It is concluded that the use of cell cultures remains currently and in the near future one of the most important methods in practical virology and in scientific research.
Full Text
Введение
Основные принципы культивирования тканей были впервые представлены В. Ру в 1885 г. и базировались на разработке С. Рингером солевых (физиологических) растворов, предназначенных для поддержания работы изолированного сердца животного. В дальнейшем Г. Хаберландт показал возможность культивирования изолированных культур растительных тканей, представив в 1902 г. идею о том, что растительные клетки способны дать начало полноценному растению. В 1940–1950-х гг., с эры антибиотиков и разработки питательных сред, методы культивирования клеток получили значительное усовершенствование и стали широко применяться в вирусологии. К 1954 г. относится создание Д. Солком вакцины против полиомиелита, что стало возможным благодаря открытию способности вируса полиомиелита расти в культурах различных тканей, сделанному Д.Ф. Эндерсом, Т.Х. Уэллером и Ф.Х. Роббинсом, и было ознаменовано получением последними Нобелевской премии.
В настоящее время клеточные культуры (КК) используются в различных областях научных исследований — от клеточной и молекулярной биологии до прикладной биотехнологии, а также находят широкое применение в медицинской практике. Прежде всего, КК являются инструментом для исследований в области вирусологии, а также для разработки новых терапевтических подходов и лекарственных противовирусных препаратов, вакцин, диагностических тест-систем. КК могут быть использованы как модель in vitro для изучения влияния различных факторов (рН, температуры, аминокислот, витаминов, гормонов, лекарственных препаратов и т.д.) на рост и развитие клеток in vivo [1]. КК применяются и для изучения иммунопатогенеза вирусных инфекций.
С понятием КК тесно связан термин «клеточная линия» (КЛ) — это совокупность клеток, полученная из первичной КК путём увеличения их количества в результате ряда генераций с преобладанием клеток или линий дифференцировки с высокими темпом роста и однородностью клеточной популяции.
Выращивание вирусов в КК в значительной степени обеспечило прогресс вирусологии. Современные методы молекулярной биологии позволили развивать генетически модифицированные КК для выявления вирусов, более чувствительные и информативные, чем ранее применяемые. Разрабатываются новые модели для исследований in vitro, а также новые методы получения КК для культивирования вирусов, в числе которых чувствительные и репортёрные клеточные системы. Однако ни одна из используемых репортёрных систем не является универсальной — все они наряду с преимуществами имеют недостатки, что ограничивает их применение для некоторых исследований. Высокоактуальными остаются работы по модификации широко используемых репортёрных систем, усовершенствованию методов определения активности репортёрных генов, поиску новых репортёров и по исследованию других био- и нанотехнологических аспектов с применением КК.
Цель обзора — дать краткую характеристику КК, полученных из тканей млекопитающих, и рассмотреть текущие возможности и перспективы их использования в вирусологии.
Виды и типы клеточных культур
КК — это гомогенная популяция генетически однородных клеток, полученных из тканей человека или животных, растущих в постоянных условиях, в специальной питательной среде при контролируемой температуре, влажности и уровне углекислого газа [1]. Наиболее распространёнными культурами дифференцированных клеток являются первичные или первично-трипсинизированные КК. Это КК, получаемые преимущественно из эмбриональной ткани человека (при прерывании беременности) или из смеси нескольких тканей эмбриональных органов животных и человека (почек, лёгких, кожи, тимуса, тестикул эмбрионов или молодых животных), клетки которых обладают более высоким потенциалом роста. Первичные КК получают также из фибробластов, кератиноцитов, меланоцитов, эндотелиальных и мышечных клеток, гематопоэтических и мезенхимальных стволовых клеток [2, 3]. Такие КК обладают рядом преимуществ по сравнению с опухолевыми и иммортализованными клетками, поскольку в большей мере соответствуют клеткам in vivo. Культуры из тканей животных легкодоступны. Доступность культур из клеток человека определяется типом ткани, из которой они получены. Кроме того, такие КК несут генотип донора, что важно для изучения причин патологии конкретного пациента на молекулярном уровне.
КК классифицируются в два типа в зависимости от используемой системы лабораторного культивирования: адгезивные и суспензионные [2]. Адгезивным КК для роста необходимо прикрепиться к поверхности лабораторного пластика или друг к другу. Примерами адгезивных клеточных линий (КЛ), используемых в вирусологии, являются A549 (эпителий лёгких человека), Vero (эпителий почек африканской зелёной мартышки), MRC-5 (фибробласты лёгких человека) и др. [2].
Суспензионные КК — это перевиваемые клетки, способные к размножению в свободно суспендированном состоянии. Ряд линий перевиваемых клеток — ВНК-21 (перевиваемая монослойно-суспензионная сублиния клеток почки новорождённого сирийского хомячка), HepG2 (КЛ гепатоцеллюлярной карциномы человека), МДВК (КК почки телёнка) и др. — были адаптированы к размножению в этих условиях [2]. Использование суспензионных КК открывает возможности для промышленного производства противовирусных вакцин и диагностикумов. Разработан подход к культивированию суспензионных культур с применением различных микроносителей (сефадекс, силикагель, цитолар и др.), где культивируемые клетки формируют монослой.
Для увеличения накопления вирусов используются смешанные КК. В этом случае разные типы клеток выращиваются в виде монослоя в одном флаконе, что выгодно для изоляции вирусов из клинических образцов, содержащих более одного вируса. Это способствует уменьшению количества КК, которые будут подвергаться инфицированию с последующей идентификацией типа вируса при помощи иммунофлюоресцентного или молекулярного анализа. Например, КЛ MRC-5 и A549 можно использовать в качестве смешанного монослоя для диагностики цитомегаловируса человека, вируса простого герпеса, аденовирусов [4].
В вирусологических исследованиях в последнее время нашли применение КК рыб. Это объясняется их универсальностью, экономической эффективностью, удобством в обработке и лёгкостью генетических манипуляций над ними. Кроме того, такие КК можно поддерживать в течение более длительного времени из-за более низких показателей метаболизма рыб. Список доступных линий к КК, включая виды рыбы и ткани, представлен в Американской коллекции культур1 и Eвропейской коллекции аутентифицированных клеточных культур2 [5].
Перевиваемые КК — это клетки, способные к размножению вне организма неопределённо длительное время, стабильны при культивировании in vitro. В лабораторных условиях такие КЛ поддерживают путём длительных пересевов в определённом режиме культивирования. Клетки таких КК имеют гетероплоидный набор хромосом, число которых может значительно колебаться, достигая 120 (например, в клетках сирийского хомячка).
Диплоидные КК — это морфологически однородные клеточные популяции, содержащие полный набор хромосом (генетического материала), получаемые из первичных КК. Их источником являются различные ткани или органы человека или животного, не имеющих онкологических и других врождённых аномалий. Диплоидная КК имеет ограниченный срок жизни, стабилизируется в процессе культивирования in vitro, характеризуется тремя фазами роста и сохраняет в процессе пассирования стабильный кариотип, свойственный исходной ткани, а также не обладает туморогенной активностью. Примерами диплоидных КК являются М-22 (диплоидный клеточный штамм фибробластов кожи и мышцы эмбриона человека), Wi-38 (диплоидная КК лёгочной ткани абортированного плода), MRC-5 (диплоидные клетки лёгочной ткани 14-недельных человеческих эмбрионов мужского пола), DBS-FRh-2 (диплоидная КЛ эмбриональной ткани макак резус) и др. [6, 7]. С использованием КЛ диплоидных клеток человека готовят вакцины против полиомиелита, краснухи, бешенства, аденовирусов, вируса герпеса, цитомегаловируса человека, риновируса и др. [6–9]. В рамках новых медицинских технологий диплоидные КЛ (в частности, линия аллогенных фибробластов) широко применяются в заместительной терапии [10].
Для получения КК, изучения их морфофункциональных свойств, накопления биомассы и хранения, а также для обеспечения клеточным материалом учреждений здравоохранения, научных и производственных лабораторий в России и за рубежом существуют национальные коллекции КК. В России самая большая коллекция перевиваемых КЛ позвоночных находится в НИИ вирусологии им. Д.И. Ивановского. Эта коллекция представлена в «Каталоге Всесоюзной коллекции клеточных культур» [11], «Каталоге Российской коллекции клеточных культур» [12], «Human and animal cell lines catalogue» [13]. На каждую из представленных в каталогах культур имеется паспорт, включающий историю получения, условия культивирования, данные по морфологии и кариологии, чувствительности к вирусам, туморогенности и контаминации.
Любая КЛ, используемая для культивирования вирусов, характеризуется чувствительностью, к которой относятся восприимчивость и пермиссивность. Чувствительность — это способность клетки к заражению небольшим количеством вируса независимо от его вида. Чувствительность к специфическим вирусам зависит как от вируса, прикреплённого к рецепторам клеточной мембраны, так и от генов-хозяев, связанных с клеточным противовирусным ответом или с присутствием соответствующих рецепторов на поверхности клеток. Восприимчивость — это свойство КЛ инфицироваться определёнными видами вирусов. Восприимчивость может быть повышена за счёт усиления экспрессии вирус-связывающих клеточных рецепторов. Пермиссивность — способность клеток поддерживать размножение вируса, т.е. обеспечивать транскрипцию и репликацию генетического материала, полноценную сборку вирионов. В лабораторных условиях пермиссивность может быть достигнута путём нокаута одного из генов противовирусного ответа или простого выбора из лабораторной коллекции чувствительных КЛ. Улучшение этих двух свойств делает КЛ удобным инструментом для выделения и исследования вирусов. Чувствительность не всегда коррелирует с пермиссивностью [14–16].
Разработан ряд технологий повышения чувствительности КК для улучшения подходов к изучению жизнеспособных вирусов. Прежде всего, это разработка чувствительных КЛ. Одна из первых чувствительных КЛ была получена для Human alphaherpesvirus-1 (HAHV-1) и содержит вирусный белок VP16 (известный как α-TIF). Наличие VP16 делает клетки более чувствительными к HAHV и в 200 раз увеличивает накопление вируса [17]. С 1990 г. началось исследование чувствительности КК к разным штаммам вируса гриппа А (H1N1, H2N2, H3N2), В, С, выделенным во время эпидемий [18].
Проблемам поиска КЛ, чувствительных к различным ДНК- и РНК-содержащим вирусам, посвящены многие работы [16, 18–20]. При изучении чувствительности КЛ в отношении ротавируса, благодаря нокауту одного гена в клетках Vero, достигнуто 18-кратное увеличение роста ротавируса [16]. В результате исследования чувствительности вируса Зика выявлены 7 КЛ из разных тканей, к которым этот вирус демонстрирует тропизм [21, 22]. Тем не менее методы получения чувствительных КЛ часто требуют много времени и не всегда легко выбрать КЛ, которая будет чувствительной и селективной для определённого типа вируса.
A.A. Dolskiy и соавт. подразделяют подходы для идентификации и изучения вирусов с использованием КК [14]. К первому подходу авторы относят метод бляшкообразования, связанный с цитопатическим эффектом вируса (сytopathogenic effect, CPE) и основанный на способности вируса размножаться, проникая в клетку. Как известно, вирусная репликация сопровождается морфологическими и биохимическими изменениями клеток хозяина, в конечном итоге приводящими к разрушению или лизису клеток. Такие видимые клеточные изменения выявляются микроскопически и отражают количество погибших клеток [14, 23]. В большинстве случаев CPE можно выявить через 5–10 дней инкубации. Для некоторых вирусов, включая цитомегаловирус, требуется 10–30 дней, а, например, для вируса HAHV-2 CPE наблюдается уже через 24 ч. Однако методы CPE являются трудоёмкими, демонстрируют низкую чувствительность и не подходят для ряда вирусов, не оказывающих цитопатического эффекта, и в таких случаях необходимы дополнительные исследования [14].
Второй подход авторы связывают с генерацией репортёрных КЛ, в которых специфические клетки в ответ на инфицирование вирусом модифицируются и продуцируют репортёрный белок. Репортёр должен быть высокоспецифичным для определённого вируса. После инфицирования вирусный белок распознаёт репортёрную конструкцию в виде вирусного генома или химерного белка. Ключевой особенностью репортёрной клеточной конструкции является репортёрный ген. Это ген, встраиваемый в генно-инженерную конструкцию, кодирующий нейтральные для клетки белки, т.е. не оказывающий влияния на физиологию клетки, экспрессию которого в КК можно наблюдать путём анализа или количественного измерения его продукта, обычно фермента. Репортёрными генами могут служить гены, кодирующие флуоресцентные и люминесцентные белки и ферменты. В их числе гены, кодирующие бактериальные ферменты β-галактозидазу, β-глюкуронидазу, хлорамфениколацетилтрансферазу, гены фермента люциферазы светлячка, а также используемый в качестве белка-репортёра зелёный флуоресцентный белок и др. [14]. Этот подход имеет целью адаптировать методы с использованием КК, сделать их более простыми, удобными и информативными. Применение репортёрных КЛ позволяет дифференцировать конкретные виды вирусов или семейства вирусов и может быть использовано для количественных исследований в качестве более быстрого аналога метода CPE [14].
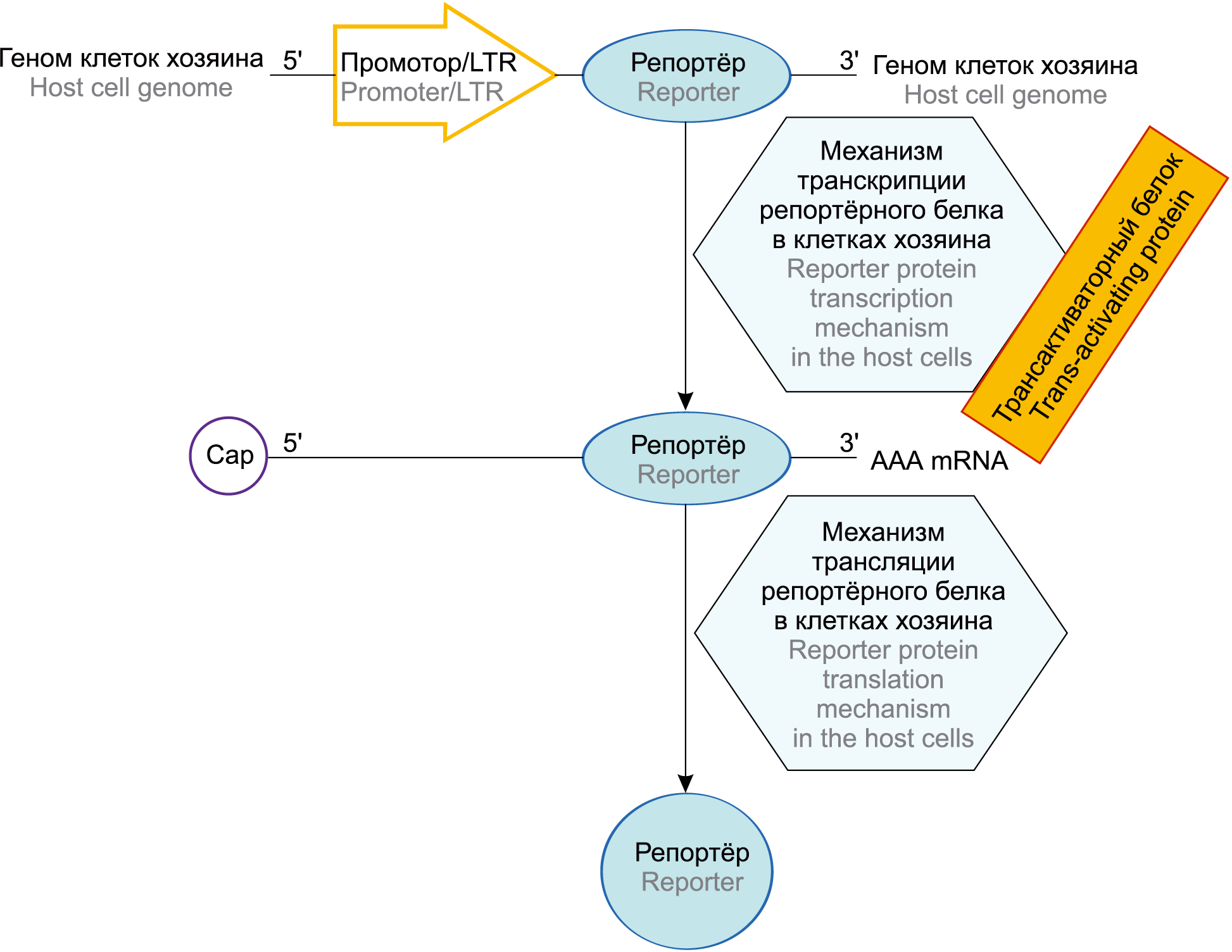
Репортёрные системы применяются в основном для получения КК человека и млекопитающих с высоким и стабильным уровнем наработки целевого белка для получения рекомбинантных белков в больших количествах для медицинских и исследовательских целей, например, для производства в биореакторах вакцинных и лекарственных препаратов. Для обнаружения репортёрной активности при исследовании различных семейств вирусов в зависимости от структуры генома и жизненного цикла существуют различные системы. Так, РНК-вирусы с отрицательной полярностью (Orthomyxoviridae и Filoviridae), реплицирующиеся в ядре хозяина, обнаруживают с использованием минигенома — сокращённой версии вирусного генома, содержащей 3'- и 5'-концевые остатки генома, необходимые для репликации и транскрипции. В минигеноме все вирусные гены удаляют и заменяют одним (невирусным) репортёрным геном, например, кодирующим флуоресцентные или люминесцентные белки (зелёный флуоресцентный белок, β-галактозидазу и др). Репортёрная система для РНК-вирусов с положительной полярностью, например Alphavirus семейства Togaviridae и Hepacivirus семейства Flaviviridae, также включает в себя минигеномную конструкцию, распознаваемую вирусными белками [24]. В качестве примера на рисунке схематически представлена молекулярная репортёрная система для обнаружения РНК-содержащих ретровирусов (например, HIV семейства Retroviridae) и вирусов с геномом двухцепочечной ДНК (например, HAHV-1, 2, 3 и цитомегаловирус семейства Herpesviridae) или частично двухцепочечного вируса гепатита В (семейства Hepadnaviridae). РНК-содержащие ретровирусы имеют уникальный путь репродукции. После проникновения в клетку генетическая информация с РНК этих вирусов переписывается на ДНК путём обратной транскрипции. Этот путь осуществляется с участием фермента обратной транскриптазы или ревертазы, который вносится в клетку в составе ретровирусов. Вновь образованная ДНК интегрирует с клеточным геномом и в его составе участвует в образовании информационной РНК (иРНК), необходимой для синтеза вирусных белков. Транскрипцию интегрированной ДНК в составе клеточных геномов (переписывание информации с ДНК на иРНК) осуществляет ДНК-зависимая РНК-полимераза. Таким образом, у ретровирусов отмечается уникальный путь передачи генетической информации: РНК → обратная транскрипция → ДНК → транскрипция → иРНК → трансляция → белок [14].
Молекулярная репортёрная система для обнаружения РНК-содержащих ретровирусов и вирусов с геномом двухцепочечной ДНК. В неинфицированных клетках нет синтеза мРНК с вирусного промотора. После инфицирования клеток начинаются транскрипция и трансляция репортёрного белка в присутствии вирусного белка. Геном или минигеном клеток хозяина — сокращенная версия вирусного генома, содержащая 3'- и 5'-концевые остатки генома, необходимые для репликации и транскрипции; промотор — участок ДНК, ответственный за связывание с РНК-полимеразой; LTR (long terminal repeat, длинный терминальный повтор) — участок генома, центр контроля экспрессии генов; репортер — ген, встраиваемый в генно-инженерную конструкцию и кодирующий нейтральные для клетки белки; трансактиваторный белок — регуляторный белок, участвующий в транскрипции вирусного генома; механизм транскрипции репортерного белка, осуществляемый в присутствии вирусного белка в клетках хозяина; механизм трансляции репортерного белка, осуществляемый в присутствии вирусного белка в клетках хозяина; Сар 5' — 5'-концевой остаток или участок генома; 3' ААА mRNA — 3'-концевой остаток поли-А-области матричной РНК.
Molecular reporter system for detecting RNA-containing retroviruses and viruses with a double-stranded DNA genome. In uninfected cells, there is no mRNA synthesis from the viral promoter. After the infection of the cells, the transcription and translation of the reporter protein begin in the presence of a viral protein. Host cell genome or minigen(ome) — a minimal gene fragment containing 3'- and 5'-terminal genome residues necessary for replication and transcription; Promoter/LTR — DNA site responsible for binding to RNA polymerase; LTR — long terminal repeat, genome site, gene expression control center; Reporter — a gene embedded in a genetically engineered structure and encoding cell-neutral proteins; Host cell transcription machinery — reporter protein transcription mechanism carried out in the presence of a viral protein in the host cells; Trans-activating protein — regulatory protein involved in viral genome transcription; Host cell translation machinery reporter protein translation mechanism carried out in the presence of a viral protein in the host cells; Сар 5' — 5'-terminal residue of genome; 3' ААА mRNA — 3'-terminal residue of poly-A region of matrix RNA.
Разработка репортёрных КЛ внесла огромный вклад не только в вирусологические исследования, но и в производство вакцин. Несмотря на то что репортёрные КЛ требуют наличия лабораторий с определённым уровнем биобезопасности, как впрочем и все работы с КК, по мнению ряда авторов, они менее трудоёмки, чем метод бляшкообразования [24, 25]. Другим преимуществом таких КЛ является более быстрое исследование вирусов, включая оценку титров вируснейтрализующих антител и антивирусной активности, т.е. этот метод требует меньшего времени для осуществления, а результаты могут быть получены в течение 12–48 ч [26]. Преимуществом также является тот факт, что репортёрные КЛ могут обнаружить небольшое количество инфицированных клеток. Например, репортёрные КЛ для вируса ветряной оспы, основанные на активности люциферазы, могут использоваться для выявления менее 10 инфицированных клеток на образец [27].
В настоящее время разработаны многочисленные репортёрные КЛ для культивирования различных вирусов, в том числе гриппа А [24], гепатита С [28], иммунодефицита человека [29, 30]. Недавно сконструированы новые репортёрные КЛ для коронавируса SARS-CoV-2, основанные на активности репортёрных генов, кодирующих флуоресцентные или люминесцентные белки. Эти КЛ рекомендованы для поиска эффективных противовирусных препаратов, в частности ингибиторов вируса SARS-CoV-2 [15, 31, 32].
Таким образом, репортёрные клеточные системы подходят как для базовых вирусологических исследований, так и для поиска противовирусных препаратов. Кроме того, такие системы перспективны в плане разработки новых КЛ для культивирования вирусов и служат источником выделения вирусных антигенов с целью получения вакцин для животных и человека.
Клеточные культуры в диагностике вирусных инфекций
Несмотря на то что в последние годы технологические достижения, включая гибридомные технологии и разработку моноклональных антител, а также методов молекулярной диагностики, предоставили надёжные инструменты для обнаружения вирусных инфекций, их диагностика традиционно опирается на использование КК. Что касается применения ПЦР-метода как одного из самых точных и чувствительных в диагностике вирусных заболеваний, некоторые авторы отмечают, что чувствительность метода ниже таковой при применении КК для культивирования определённых вирусов, например вирусов кишечных инфекций человека [33, 34]. Кроме того, методы на основе ПЦР позволяют обнаружить только вирусный геном, а не живой вирус, эти методы дороги и требуют значительного опыта, а их использование может быть связано с ложноположительными результатами [33]. Простое обнаружение вируса с использованием молекулярных методов — это только первый шаг; необходимо определить, связан ли идентифицированный возбудитель с заболеванием, что можно выявить только с помощью КК, называемой авторами «золотым стандартом» в выявлении вирусов и обнаружении причинно-следственной связи с заболеванием [34].
КК широко применяют для получения моноклональных антител, используемых при разработке диагностических тест-систем и представляющих перспективу для терапии инфекций. Так, разработаны тест-системы для диагностики вируса гриппа А и В, вируса иммунодефицита человека, вируса простого герпеса, вирусов гепатита А, В и С, SARS-CoV-2, вируса клещевого энцефалита, цитомегаловируса, вируса краснухи, респираторно-синцитиального вируса и др. [34–37].
Таким образом, отвечая на вопросы, поставленные D.S. Leland и соавт.: «является ли выделение вирусов на КК все ещё полезным подходом в диагностике вирусных инфекций?» и «будут ли КК в будущем применяться в лабораторной диагностической вирусологии?» [38], можно смело дать утвердительный ответ.
Клеточные культуры в разработке вакцин и лекарственных препаратов
Важным аспектом применения КК является вакцинология. КК используются в качестве субстрата для производства культуральных вакцин. Разрабатываются дизайнерские линии для производства противовирусных вакцин [39]. С использованием КК получены различные вакцины, в том числе против вирусов простого герпеса-1, 2 и 3, гепатита В, краснухи, гриппа А и В, клещевого энцефалита, полиомиелита, кори, паротита и др. [14, 39–41].
В Институте полиомиелита и вирусных энцефалитов им. М.П. Чумакова разработана живая полиовакцина трех типов на первичных КК почек обезьян. Исследована репродукция вакцинных штаммов Л-16 вируса кори и Л-3 вируса паротита на клетках линии М-22, что открыло перспективы для создания отечественной тривакцины. С использованием линии М-22 и ленинградского вакцинного штамма «Орлов-Д» разработана первая отечественная вакцина против краснухи. Сотрудниками этого НИИ разработана новая линия 4647 на основе почек зелёных мартышек, идентичная зарубежной линии Vero (эпителий почки африканской зелёной мартышки), пригодная для выпуска различных вакцин, производимых в настоящее время в России. Важным положительным качеством линии 4647 является широкий спектр чувствительности к вирусам практически всех таксономических групп. С использованием этой линии приготовлены экспериментальные серии вакцины против вируса бешенства, а также первая в отечественной практике вакцина против вируса гепатита А, экспериментальные серии вакцин против вирусов клещевого энцефалита, натуральной оспы и др. [42]. Для получения первой отечественной противогерпетической вакцины «Витагерпавак» разработана и охарактеризована по требованиям ВОЗ вакцинная линия клеток Vеrо (В) [43].
КК млекопитающих также применяют для выделения вирусных антигенов с целью получения ДНК-вакцин. В этом случае вакцинные КК получают при использовании техники рекомбинантных ДНК и векторов экспрессии для КК. Выпуск культуральных и генно-инженерных вакцин связан с получением больших объёмов вируса, в связи с чем в настоящее время для их производства применяются биореакторы. В работе Z. Fang и соавт. представлены широкие возможности использования биореакторов для получения вакцин и сделано заключение о том, что биореакторы способны обеспечить более масштабное и экономически эффективное производство вакцин для удовлетворения глобального спроса здравоохранения [44].
Системы экспериментальных моделей на КК применяются также на этапах доклинических испытаний для подтверждения безопасности, эффективности, стандартизации и валидации новых лекарственных средств, в частности противовирусных препаратов, а также биологически активных веществ, косметических средств и пищевых добавок [45–49]. Отмечается, что использование различных КК в качестве тест-объектов способствует выбору наилучшей системы для оптимальной оценки новых фармакологических, лечебных и косметических средств [50, 51].
Клеточные культуры для изучения иммунопатогенеза вирусных инфекций
КК также служат для решения не менее важной задачи — исследования влияния вирусов на иммунную систему макроорганизма или механизмов иммунопатогенеза вирусных инфекций, а также механизмов синтеза цитокинов. В качестве примера можно привести исследование механизмов иммунопатогенеза новой коронавирусной инфекции. Поскольку клетки Vero, которые являются стандартной культурой для выращивания SARS-CoV-2, не имеют генов IFN типа I и не могут использоваться для анализа продукции цитокинов [52], в поисках подходящей системы in vitro протестировано несколько IFN-компетентных КЛ человека в отношении этого вируса. В результате ряда исследований отобраны клетки линии Caco-2 (эпителиоподобная линия клеток аденокарциномы ободочной кишки человека) и HEK 293 (КЛ почек эмбриона человека) как полезные системы для изучения влияния SARS-CoV-2 на независимую от иммунной системы индукцию цитокинов [47, 48, 53]. M. Spiegel и соавт. установили, что вирус SARS-CoV-2 способен значительно подавлять противовирусный цитокиновый ответ инфицированных клеток [54]. Однако индукция хемокинов IP-10 и IL-8 избегает подавления SARS-CoV-2 в клетках Caco-2, но не в HEK 293. На основании этих исследований авторами сделано заключение о том, что SARS-CoV-2 эффективно блокирует механизмы врождённого иммунитета клеток-хозяев на очень ранней стадии заражения, выигрывая время для колонизации хозяина. Эти данные объясняют, как быстрый рост титров вируса на начальной стадии заболевания, вызванный подавлением продукции противовирусных цитокинов и прогрессирующей инфильтрацией иммунных клеток в инфицированные лёгкие, связан с выработкой хемокинов инфицированными тканевыми клетками [54]. Учитывая, что в патогенезе новой коронавирусной инфекции имеет место активация цитокинов, приводящая к эндотелиальной дисфункции, способствующей прокоагулянтному состоянию и тромбообразованию, исследовано влияние SARS-CoV-2 на уровень провоспалительных цитокинов, хемокинов и тканевого фактора у человека с использованием культуры микрососудистых эндотелиальных клеток человека (HMEC-1). M. Dolci и соавт. показали, что HMEC-1 in vitro подвержены инфицированию SARS-CoV-2 и способствуют амплификации вируса, который в свою очередь может вызвать увеличение продуцируемых медиаторов [55].
Клеточные культуры в биотехнологических разработках
В нашем обзоре рассматриваются традиционные монослойные (2D) КК. Однако в 2D-КК невозможно воспроизвести клеточное микроокружение, которое существует in vivo. Культивирование клеток в трёхмерном пространстве (3D) способно устранить эти ограничения. 3D-КК обычно выращиваются в биореакторах, в которых клетки могут превращаться в 3D-клеточные колонии. 3D-культивирование включает многочисленные типы клеток и тканей, компоненты среды и биохимическое микроокружение в их взаимодействии. Существует множество платформ, используемых для выращивания 3D-клеточных структур, включая различные системы каркасов, таких как твёрдые или гидрогелевые матрицы [56]. В качестве примера можно привести углеродные нанотрубки, используемые в тканевой инженерии в роли каркасного материала для 3D-культивирования клеток, поскольку они имеют геометрически близкую структуру с коллагеном — белком соединительной ткани животных. Этот материал способен создать соответствующее микроокружение клеток, обеспечивая их пролиферацию и дифференцировку [57]. Широкое применение в создании биоинженерных гидрогелевых каркасов получили природные биополимеры из морских гидробионтов, позволяющие максимально имитировать структуру и свойства тканей и органов и создавать близкое к натуральному клеточное микроокружение [58]. Такие каркасы способствуют эффективному заселению стволовыми клетками и их дифференцировке в нужные типы клеток с целью последующего использования в заместительной и клеточной терапии, реконструкции различных тканей и органов, что является одним из перспективных направлений в биотехнологии с использованием КК [10, 59–61]. G. Varan и соавт. подчёркивают важность использования 3D-методов культивирования клеток для изучения патогенеза инфекционных заболеваний и для характеристики новых вакцинных препаратов [41].
Заключение
Таким образом, возможности применения КК в вирусологии весьма разнообразны. Использование КК в настоящее время и в ближайшей перспективе остаётся одним из важнейших методов в вирусологии и на протяжении десятилетий рассматривается как «золотой стандарт» для лабораторной диагностики вирусных заболеваний.
Очевидны преимущества КК как экспериментальных систем in vitro по сравнению с исследованиями на животных in vivo: результаты экспериментов, требующих использования большого числа лабораторных животных или куриных эмбрионов и соблюдения определённых этических норм, могут быть с аналогичной статистической достоверностью получены на КК. Кроме того, клетки в КК могут быть подвержены воздействию токсинов, гормонов, радиоактивных веществ в любых количествах и на любой период времени.
С применением методов молекулярной биологии повышены чувствительность и специфичность КК для определённых вирусов путём генерации репортёрных КЛ. Разработка новых репортёрных КЛ в сочетании с молекулярными методами диагностики является многообещающим инструментом для выявления существующих, а также новых неизвестных вирусных инфекций.
Применение чувствительных КК представляет чрезвычайную важность для изучения иммунопатогенеза вирусных инфекций и при разработке подходов для лечения вирусных заболеваний, а также для разработки новых лекарственных противовирусных препаратов и диагностических тест-систем. Особое внимание следует при этом уделять изучению вирусов с высокой степенью изменчивости генома, таких как коронавирусы, вирусы гриппа, ВИЧ и др., способных приводить к эпидемиям. Это касается не только вирусов, инфицирующих человека, но и вирусов, патогенных для животных и сельскохозяйственных растений.
Кроме того, возможность накопления вируса в виде культуральной жидкости при соблюдении полной её стерильности в отношении посторонней флоры представляет особую важность для разработки вакцин. В результате получены многочисленные высокоэффективные вакцинные препараты для профилактики вирусных инфекций.
Используя КК, можно охарактеризовать свойства вирусов, обеспечить непрерывность контроля за развитием инфекционного процесса, что чрезвычайно важно при разработке подходов к лечению новых вирусных заболеваний. Кроме того, морфология вирусов, выращенных на КК, может быть изучена с помощью электронной микроскопии. Репликация вирусов в КК также обеспечивает получение клинического изолята, который может быть использован для дополнительных исследований, таких как изучение взаимодействия вируса и клеток хозяина, антивирусной активности, серотипирование, эпидемиологическая оценка, а также подробное изучение структуры вируса, стадий и механизмов его репликации.
КК тканей также используются в цитологии, гистологии, физиологии, генной инженерии, онкологии, биотехнологии. В настоящее время открываются новые перспективные возможности использования КК в современных эффективных биомедицинских технологиях. Одним из наиболее перспективных направлений в био- и нанотехнологии является реконструкция различных тканей и органов. В силу ограниченного объёма обзора мы охарактеризовали основные возможности использования КК в вирусологии и лишь упомянули биотехнологические и другие перспективные аспекты их применения в медицине.
1 American Type Culture Collection. URL: http://www.atcc.org
2 European Collection of Authenticated Cell Cultures.
About the authors
Tatyana A. Kuznetsova
G.Р. Somov Institute of Epidemiology and Microbiology of Rospotrebnadzor
Author for correspondence.
Email: takuznets@mail.ru
ORCID iD: 0000-0002-4315-6959
D. Sci. (Med.), main researcher, Laboratory of diagnostic preparates, G.P. Somov Institute of Epidemiology and Microbiology
Russian Federation, VladivostokNatalia N. Besednova
G.Р. Somov Institute of Epidemiology and Microbiology of Rospotrebnadzor
Email: besednoff_lev@mail.ru
ORCID iD: 0000-0002-2760-9778
D. Sci. (Med.), Professor, Academician of RAS, main researcher, Laboratory of diagnostic preparates, G.P. Somov Institute of Epidemiology and Microbiology
Russian Federation, VladivostokMaxim R. Aliev
G.Р. Somov Institute of Epidemiology and Microbiology of Rospotrebnadzor
Email: maximaliev63@gmail.com
ORCID iD: 0000-0003-1676-1405
laboratory researcher, Laboratory of diagnostic preparates, G.P. Somov Institute of Epidemiology and Microbiology
Russian Federation, VladivostokMichail Y. Shchelkanov
G.Р. Somov Institute of Epidemiology and Microbiology of Rospotrebnadzor
Email: adorob@mail.ru
ORCID iD: 0000-0001-8610-7623
D. Sci. (Biol.), Director, G.P. Somov Institute of Epidemiology and Microbiology
Russian Federation, VladivostokReferences
- Davis P.K., Ho A., Dowdy S.F. Biological methods for cell-cycle synchronization of mammalian cells. Bitechniques. 2001;30(6):1322–31. DOI: https://doi.org/10.2144/01306rv01
- WHO. Use of cell culture in Virology for developing countries in the South-East Asia region;2017.
- Uysal O., Sevimli T., Sevimli M., et al. Cell and tissue culture: the base of biotechnology. In: Barh D., Azevedo V., eds. Omics Technologies and Bio-Engineering. Towards Improving Quality of Life. Volume 1. Elsevier;2018:391–429. DOI: https://doi.org/10.1016/b978-0-12-804659-3.00017-8
- Hematian A., Sadeghifard N., Mohebi R., et al. Traditional and modern cell culture in virus diagnosis. Osong. Public Health Res. Perspect. 2016;7(2):77–82. DOI: https://doi.org/10.1016/j.phrp.2015.11.011
- Aarattuthodi S., Dharan V., Koshy M. Fish cell cultures — uses and prospects. J. Aquac. Res. Dev. 2021;13:667. DOI: https://doi.org/10.35248/2155-9546.22.13.667
- Гаврилов Л.А., Гаврилова Н.С. Культура диплоидных клеток как объект изучения молекулярных механизмов старения. Успехи современной биологии. 1978;85(2):267–83. Gavrilov L.A., Gavrilova N.S. Diploid cell cultures as an object for the study of the molecular mechanisms of aging. Successes of Modern Biology. 1978;85(2):267–83.
- Нагиева Ф.Г., Баркова Е.П., Лисаков А.Н. и др. Практические аспекты выявления, культивирования и характеристики изолятов вируса Varicella-zoster. Инфекция и иммунитет. 2020;10(2):387–96. Nagieva F.G., Barkova E.P., Lisakov A.N., et al. Practical aspects on identification, cultivation and characteristics of Varicella-zoster virus isolates. Russian Journal of Infection and Immunity. 2020;10(2):387–96. DOI: https://doi.org/10.15789/2220-7619-PAO-1211 EDN: https://elibrary.ru/ptnvte
- Shridhar Rao P.N. Diploid cells culture. Microbiol notes; 2006. URL: http://microrao.com/micronotes/diploid_cell_culture.htm
- Fletcher M.A. Human diploid cell strains (HDCS) viral vaccines. Dev. Biol. Stand. 1998;93:97–107.
- Петручук Е.М., Шалунова Н.В., Олефир Ю.В. и др. Культуры клеток в заместительной терапии. БИОпрепараты. Профилактика, диагностика, лечение. 2017;17(4):197–206. Petruchuk E.M., Shalunova N.V., Olefir Yu.V., et al. Cell cultures in replacement therapy. Biological Products. Prevention, Diagnosis, Treatment. 2017;17(4):197–206. EDN: https://elibrary.ru/zxgljp
- Каталог Всероссийской коллекции клеточных культур. СПб.: Наука; 1991. Catalog of the Russian Collection of Cell Cultures. St. Petersburg: Nauka;1991.
- Каталог Российской коллекции клеточных культур (РККК). СПб., Омск;1999. Catalog of the Russian Collection of Cell Cultures (RKKK). St. Petersburg, Omsk;1999.
- Parodi B. Human and Animal Cell Lines Catalogue. Geneva;1993.
- Dolskiy A.A., Grishchenko I.V., Yudkin D.V. Cell cultures for virology: usability, advantages, and prospects. Int. J. Mol. Sci. 2020;21(21):7978. DOI: https://doi.org/10.3390/ijms21217978
- Ju X., Zhu Y., Wang Y., et al. A novel cell culture system modeling the SARS-CoV-2 life cycle. PLoS Pathog. 2021;17(3):e1009439. DOI: https://doi.org/10.1371/journal.ppat.1009439
- Wu W., Orr-Burks N., Karpilow J., Tripp R.A. Development of improved vaccine cell lines against rotavirus. Sci. Data. 2017;4:1–12. DOI: https://doi.org/10.1038/sdata.2017.21
- Werstuck G., Bilan P., Capone J.P. Enhanced infectivity of herpes simplex virus type 1 viral DNA in a cell line expressing the trans-inducing factor Vmw65. J. Virol. 1990;64:984–91. DOI: https://doi.org/10.1128/JVI.64.3.984-991.1990
- Даниленко Д.М., Смирнова Т.Д., Гудкова Т.М. и др. Сравнительное изучение чувствительности клеточных линий различного происхождения к вирусам пандемического гриппа H1N1, вирусам гриппа птиц, свиней, человека. Вопросы вирусологии. 2011;56(6):14–9. Danilenko D.M., Smirnova T.D., Gudkova T.M., et al. Comparative study of the differential susceptibility of different cell lines to pandemic H1N1V influenza viruses and avian influenza, swine influenza, and human influenza viruses. Problems of Virology. 2011;56(6):14–9. EDN: https://elibrary.ru/ooqzsh
- Львов Д.К., Бурцева Е.И., Щелканов М.Ю. и др. Распространение нового пандемического вируса гриппа A(H1N1) в России. Вопросы вирусологии. 2010;55(3):4–9. L'vov D.K., Burtseva E.I., Shchelkanov M.Yu., et al. Spread of new pandemic influenza A(H1N1) virus in Russia. Problems of Virology. 2010;55(3):4–9. EDN: https://elibrary.ru/muekip
- Захарова Ю.А., Остапчук А.В., Василевский В.В. и др. Характеристика чувствительности новых клеточных культур животного происхождения к вирусам Coxsackievirus B5 и Herpes simplex virus-1. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(1):102–10. Zakharova Yu.A., Ostapchuk A.V., Vasilevskiy V.V, et al. Characterisation of new animal cell cultures’ sensitivity to Coxsackievirus B5 and Herpes simplex virus-1. Biological Products. Prevention, Diagnosis, Treatment. 2023;23(1):102–10. DOI: https://doi.org/10.30895/2221-996X-2023-23-1-7-15
- Chan J.F.W., Yip C.C.Y., Tsang J.O.L., et al. Differential cell line susceptibility to the emerging Zika virus: Implications for disease pathogenesis, non-vector-borne human transmission and animal reservoirs. Emerg. Microbes Infect. 2016;5(8):e93. DOI: https://doi.org/10.1038/emi.2016.99
- Пименова Е.В., Храпова Н.П., Замарина Т.В. Модели in vitro для изучения вируса Зика. Журнал микробиологии, эпидемиологии и иммунобиологии. 2020;97(2):159–64. Pimenova E.V., Khrapova N.P., Zamarina T.V. In vitro models for the study of Zika virus. Journal of Microbiology, Epidemiology and Immunobiology. 2020;97(2):159–64. DOI: https://doi.org/10.36233/0372-9311-2020-97-2-159-164 EDN: https://elibrary.ru/wltpwu
- Dulbecco R. Production of plaques in monolayer tissue cultures by single particles of an animal virus. Proc. Natl Acad. Sci. USA. 1952;38:747–52. DOI: https://doi.org/10.1073/pnas.38.8.747
- Lee J.C., Tseng C., Chen K.J., et al. A cell-based reporter assay for inhibitor screening of hepatitis C virus RNA-dependent RNA polymerase. Anal. Biochem. 2010;403(1-2):52–62. DOI: https://doi.org/10.1016/j.ab.2010.04.004
- Lutz A., Dyall J., Olivo P.D., Pekosz A. Virus-inducible reporter genes as a tool for detecting and quantifying influenza A virus replication. J. Virol. Methods. 2005;126(1-2):13–20. DOI: https://doi.org/10.1016/j.jviromet.2005.01.016
- Kainulainen M.H., Nichol S.T., Albariño C.G., Spiropoulou C.F. Rapid determination of ebolavirus infectivity in clinical samples using a novel reporter cell line. J. Infect. Dis. 2017;216:1380–85. DOI: https://doi.org/10.1093/infdis/jix486
- Wang G., Suzutani T., Yamamoto Y., et al. Generation of a reporter cell line for detection of infectious varicella-zoster virus and its application to antiviral studies. Antimicrob. Agents Chemother. 2006;50(9):3142–5. DOI: https://doi.org/10.1128/AAC.00342-06
- Lee J.C., Chang C.F., Chi Y.H., et al. A reporter-based assay for identifying hepatitis C virus inhibitors based on subgenomic replicon cells. J. Virol. Methods. 2004;116(1):27–33. DOI: https://doi.org/10.1016/j.jviromet.2003.10.007
- Felber B.K., Pavlakis G.N. A quantitative bioassay for HIV-1 based on trans-activation. Science. 1988;239(4836):184–7. DOI: https://doi.org/10.1126/science.3422113
- Kimpton J., Emerman M. Detection of replication-competent and pseudotyped human immunodeficiency virus with a sensitive cell line on the basis of activation of an integrated beta-galactosidase gene. J. Virol. 1992;66(4):2232–9. DOI: https://doi.org/10.1128/JVI.66.4.2232-2239.1992
- Froggatt H.M., Heaton B.E., Heaton N.S. Development of a fluorescence-based, high-throughput SARS-CoV-2 3CLpro reporter assay. J. Virol. 2020;94(22):e01265–20. DOI: https://doi.org/10.1128/JVI.01265-20
- Rawson J.M.O., Duchon A., Nikolaitchik O.A., et al. Development of a cell-based luciferase complementation assay for identification of SARS-CoV-2 3CLpro inhibitors. Viruses. 2021;13(2):173. DOI: https://doi.org/10.3390/v13020173
- Kohl C., Brinkmann A., Dabrowski P.W., et al. Protocol for metagenomic virus detection in clinical specimens. Emerg. Infect. Dis. 2015;21(1):48–57. DOI: https://doi.org/10.3201/eid2101.140766
- Hudu S.A., Alshrari A.S., Syahida A., Sekawi Z. Cell culture, technology: enhancing the culture of diagnosing human diseases. J. Clin. Diagn. Res. 2016;10(3):DE01–5. DOI: https://doi.org/10.7860/JCDR/2016/15837.7460
- Hematian A., Sadeghifard N., Mohebi R., et al. Traditional and modern cell culture in virus diagnosis. Osong Public Health Res. Perspect. 2016;7(2):77–82. DOI: https://doi.org/10.1016/j.phrp.2015.11.011
- Dronina J., Samukaite-Bubniene U., Ramanavicius A. Advances and insights in the diagnosis of viral infections. J. Nanobiotechnology. 2021;19(1):348. DOI: https://doi.org/10.1186/s12951-021-01081-2
- Демидова Н.А., Климова Р.Р., Кущ А.А. и др. Получение и характеристика моноклональных антител к G-белку респираторно-синцитиального вируса. Журнал микробиологии, эпидемиологии и иммунобиологии. 2020;97(1):7–14. Demidova N.A., Klimova R.R., Kushch A.A., et al. Obtaining and characterization of the monoclonal antibodies against G-protein of the respiratory syncytial virus. Journal of microbiology epidemiology and immunobiology. 2020;97(1):7–14. DOI: https://doi.org/10.36233/0372-9311-2020-97-1-7-14 EDN: https://elibrary.ru/fxehvq
- Leland D.S., Ginocchio C.C. Role of cell culture for virus detection in the age of technology. Clin. Microbiol. Rev. 2007;20(1):49–78. DOI: https://doi.org/10.1128/CMR.00002-06
- Genzel Y. Designing cell lines for viral vaccine production: Where do we stand? Biotechnol. J. 2015;10(5):728–40. DOI: https://doi.org/10.1002/biot.201400388
- Graham B.S. Advances in antiviral vaccine development. Immunol. Rev. 2013;255(1):230–42. DOI: https://doi.org/10.1111/imr.12098
- Varan G., Unal S. Three-dimensional cell culture methods in infectious diseases and vaccine research. Future Pharmacol. 2023;3(1):48–60. DOI: https://doi.org/10.3390/futurepharmacol3010004
- Миронова Л.Л. Разные аспекты применения культур клеток в вакцинологии. Фундаментальные исследования. 2009;(9):60–2. Mironova L.L. Different aspects of the use of cell cultures in vaccinology. Fundamental Research. 2009;(9):60–2. EDN: https://elibrary.ru/kxpzdx
- Бархалёва О.А., Ладыжинская И.П., Воробьёва М.С. и др. «Витагерпавак» — первая отечественная вакцина на перевиваемой линии клеток Vero (B). Вопросы вирусологии. 2009;54(5):33–7. Barkhaleva O.A., Ladyzhinskaya I.P., Vorob'eva M.S., et al. Vitaherpavac is the first Russian herpes simplex virus vaccine obtained on the Vero B continuous cell line. Problems of Virology. 2009;54(5):33–7. EDN: https://elibrary.ru/lajyjb
- Fang Z., Lyu J., Li J., et al. Application of bioreactor technology for cell culture-based viral vaccine production: рresent status and future prospects. Front. Bioeng. Biotechnol. 2022;10:921755. DOI: https://doi.org/10.3389/fbioe.2022.921755
- Andersen P.I., Ianevski A., Lysvand H., et al. Discovery and development of safe-in-man broad-spectrum antiviral agents. Int. J. Infect. Dis. 2020;93:268–76. DOI: https://doi.org/10.1016/j.ijid.2020.02.018
- Bojkova D., Reus P., Panosch L., et al. Identification of novel antiviral drug candidates using an optimized SARS-CoV-2 phenotypic screening platform. iScience. 2023;26(2):105944. DOI: https://doi.org/10.1016/j.isci.2023.105944
- Dittmar M., Lee J.S., Whig K., et al. Drug repurposing screens reveal cell-type-specific entry pathways and FDA-approved drugs active against SARS-CoV-2. Cell Reports. 2021;35(1):108959. DOI: https://doi.org/10.1016/j.celrep.2021.108959
- Kumar S., Sarma P., Kaur H., et al. Clinically relevant cell culture models and their significance in isolation, pathogenesis, vaccine development, repurposing and screening of new drugs for SARS-CoV-2: a systematic review. Тissue Cell. 2021;70:101497. DOI: https://doi.org/10.1016/j.tice.2021.101497
- Krylova N.V., Silchenko A.S., Pott A.B., et al. In vitro anti-orthohantavirus activity of the high-and low-molecular-weight fractions of fucoidan from the brown alga Fucus evanescens. Mar. Drugs. 2021;19(10):577. DOI: https://doi.org/10.3390/md19100577
- Нагиева Ф.Г., Баркова Е.П., Федотов А.Ю. и др. Перспективная культуральная модель для контроля биологической активности интерферонов человека. Журнал микробиологии, эпидемиологии и иммунобиологии. 2015;92(5):39–44. Nagieva F.G., Barkova E.P., Fedotov A.Yu., et al. A perspective cultural model for control of biological activity of human interferons. Journal of Microbiology, Epidemiology and Immunobiology. 2015;92(5):39–44. EDN: https://elibrary.ru/zqjydr
- Алпатова Н.А., Гайдерова Л.А., Яковлев А.К. и др. Особенности определения специфической активности биотехнологических лекарственных средств. БИОпрепараты. Профилактика, диагностика, лечение. 2017;17(1):13–26. Alpatova N.A., Gayderova L.A., Yakovlev A.K., et al. Assessment of biotechnological products specific activity. Biological Products. Prevention, Diagnosis, Treatment. 2017;17(1):13–26. EDN: https://elibrary.ru/yhssgl
- Emeny J.M., Morgan M.J. Regulation of the interferon system: evidence that Vero cells have a genetic defect in interferon production. J. Gen. Virol. 1979;43(1):247–52. DOI: https://doi.org/10.1099/0022-1317-43-1-247
- Pires De Souza G.A., Le Bideau M., Boschi C., et al. Choosing a cellular model to study SARS-CoV-2. Front. Cell. Infect. Microbiol. 2022;12:1003608. DOI: https://doi.org/10.3389/fcimb.2022.1003608
- Spiegel M., Weber F. Inhibition of cytokine gene expression and induction of chemokine genes in non-lymphatic cells infected with SARS coronavirus. Virol. J. 2006;3:17. DOI: https://doi.org/10.1186/1743-422X-3-17
- Dolci M., Signorini L., D’Alessandro S., et al. In vitro SARS-CoV-2 infection of microvascular endothelial cells: effect on pro-inflammatory cytokine and chemokine release. Int. J. Mol. Sci. 2022;23(7):4063. DOI: https://doi.org/10.3390/ijms23074063
- Волкова И.М., Коровина Д.Г. Трёхмерные матриксы природного и синтетического происхождения для клеточной биотехнологии. Биотехнология. 2015;31(2):8–26. Volkova I.M., Korovina D.G. Three-dimensional matrixes of natural and synthetic origin for cell biotechnology. Biotechnology. 2015;51(9):841–56. DOI: https://doi.org/10.1134/S0003683815090082 EDN: https://elibrary.ru/vajqzx
- Бобринетский И.И., Морозов Р.А., Селезнёв А.С. и др. Исследование пролиферативной активности и жизнеспособности клеток фибробласта и глиобластомы на различных типах углеродных нанотрубок. Бюллетень экспериментальной биологии и медицины. 2012;153(2):227–31. Bobrinetsky I.I., Morozov R.A., Seleznev A.S., et al. Proliferative activity and viability of fibroblast and glioblastoma cell on various types of carbon nanotubes. Bulletin of Experimental Biology and Medicine. 2012; 153(2):259–62. DOI: https://doi.org/10.1007/s10517-012-1690-z EDN: https://elibrary.ru/dzkwco
- Kuznetsova T.A., Andryukov B.G., Besednova N.N., et al. Marine algae polysaccharides as basis for wound dressings, drug delivery, and tissue engineering: a review. J. Mar. Sci. Eng. 2020;8(7):481. DOI: https://doi.org/10.3390/jmse8070481 EDN: https://elibrary.ru/xevoja
- Volarevic V., Markovic B.S., Gazdic M., et al. Ethical and safety issues of stem cell-based therapy. Int. J. Med. Sci. 2018;15(1):36–45. DOI: https://doi.org/10.7150/ijms.21666
- Ghaedi M., Niklason L.E. Human Pluripotent Stem Cells (iPSC) generation, culture, and differentiation to lung progenitor cells. In: Turksen L., ed. Organoids. Methods in Molecular Biology, Volume 1576. New York;2019:55–92. DOI: https://doi.org/10.1007/7651_2016_11
- Song W.K., Park K.M., Kim H.J., et al. Treatment of macular degeneration using embryonic stem cell-derived retinal pigment epithelium: preliminary results in Asian patients. Stem. Cell Rep. 2015;4(5):860–72. DOI: https://doi.org/10.1016/j.stemcr.2015.04.005
Supplementary files