Диагностическое значение рецепторов TLR2 и TLR4 на лимфоидных клетках как маркера прогрессирования воспаления пародонта, ассоциированного с ключевыми пародонтопатогенными видами F. alocis и P. gingivalis
- Авторы: Царев В.Н.1, Николаева Е.Н.1, Ипполитов Е.В.1, Царева Т.В.1, Подпорин М.С.1, Балмасова И.П.1,2
-
Учреждения:
- Московский государственный медико-стоматологический университет им. А.И. Евдокимова
- Российский университет дружбы народов
- Выпуск: Том 99, № 5 (2022)
- Страницы: 565-572
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/1341
- DOI: https://doi.org/10.36233/0372-9311-336
- ID: 1341
Цитировать
Полный текст
Аннотация
Цель работы — оценка диагностического значения экспрессии TLR2 и TLR4 на лимфоидных клетках пародонта и периферической крови методом иммунофлюоресцентной микроскопии у больных хроническим пародонтитом (ХП), ассоциированным с ключевыми пародонтопатогенными видами Filifactor alocis и Porphyromonas gingivalis.
Материалы и методы. В исследование были включены 150 пациентов — 88 (59%) женщин и 62 (41%) мужчины в возрасте 18–73 лет с ХП в фазе обострения и 32 человека без признаков ХП. Для подтверждения диагноза пародонтита использовали набор для полимеразной цепной реакции (ПЦР) «МультиДент-5» (выявление P. gingivalis, Prevotella intermedia, Tannerella forsythia, Treponema denticola, Aggregatibacter actinomycetemcomitans), а также rt-PCR — для F. alocis и P. gingivalis в содержимом пародонтального кармана. Для оценки клеток, несущих маркеры CD282 и СD284, использовали смывы десневой жидкости из пародонтального кармана раствором Хенкса. Выделенные клетки окрашивали антителами к маркерам CD282 (соответствует рецептору TLR2) или СD284 (соответствует рецептору TLR4), меченными изотиоцианатом флуоресцеина, и фиксировали параформальдегидом для последующей иммунофлюоресцентной микроскопии.
Результаты. Изучена экспрессия TLR2 и TLR4 на лейкоцитах периферической крови и десневой жидкости у людей со здоровым пародонтом и больных ХП, ассоциированным с F. alocis и P. gingivalis. По результатам ПЦР частота выявления F. alocis и P. gingivalis составила 64 и 62,7% соответственно, что подтверждало их доминирование в микробной ассоциации. Установлено, что экспрессия TLR2 и TLR4 на лимфоидных клетках периферической крови у людей варьировала. Обсуждается возможное диагностическое значение этого феномена при оценке прогрессирования ХП.
Заключение. У больных ХП, ассоциированным с доминированием пародонтопатогенных видов F. alocis и P. gingivalis, выявлена разнонаправленная экспрессия TLR2 и TLR4 на клетках периферической крови, которая может иметь диагностическое значение при оценке прогрессирования заболеваний пародонта.
Ключевые слова
Полный текст
Введение
Хронический пародонтит (ХП) начинается с последовательной колонизации слизистой оболочки полости рта и дёсен пародонтопатогенными бактериями, индуцирующими воспалительную реакцию с привлечением факторов врождённого и адаптивного иммунитета, которые, в свою очередь, влияют на микробную биоплёнку десны [1–7]. Распознавание микробов опосредуется Toll-подобными рецепторами (Тoll-like receptors — TLR), которые взаимодействуют с консервативными патоген-ассоциированными молекулярными паттернами. Установлено, что распознавая определённые паттерны, TLR, в частности TLR-2 и TLR-4, взаимодействуют с большинством пародонтопатогенных видов бактерий [2, 8–10].
В последние годы уделяется большое внимание TLR как факторам врождённого иммунитета. Универсальность механизмов, обусловленная как широким представительством данных маркеров на разнообразных клетках организма, так и широким спектром лигандов для них, определяет включение TLR в патогенетические звенья развития многих инфекционно-воспалительных заболеваний [9, 10]. Среди основных процессов следует назвать нарушения экспрессии TLR и распознавания лигандов, трансдукции сигналов, выработки эффекторных молекул, а также полиморфизм генов TLR [5, 11]. Дефекты молекул, участвующих в трансдукции сигнала от TLR, по-видимому, лежат в основе повышенной восприимчивости к инфекционным болезням [11].
В исследованиях роли TLR при заболеваниях пародонта, в том числе связанных с системными эффектами пародонтопатогенных бактерий [12, 13], показано проявление этих нарушений при атеросклерозе, инфекционных, аутоиммунных, аллергических и некоторых других заболеваниях [10, 14–16]. Ведущую роль в запуске системных эффектов пародонтопатогенных бактерий играет ассоциация основного возбудителя Porphyromonas gingivalis и нового, недавно открытого благодаря технологиям метагеномного анализа и претендующего на ключевую роль — Filifactor alocis [9, 17].
Значимость этих механизмов для широкой клинической практики определяет необходимость внедрения адекватных и надёжных методов оценки компонентов системы TLR, которые могут быть воспроизведены в условиях клинической лаборатории лечебно-профилактических учреждений.
Целью работы являлась оценка диагностического значения экспрессии TLR2 и TLR4 на лимфоидных клетках пародонта и периферической крови методом иммунофлюоресцентной микроскопии у больных ХП, ассоциированным с ключевыми пародонтопатогенными видами F. alocis и P. gingivalis.
Материалы и методы
В исследование были включены 150 пациентов с ХП в фазе обострения, в том числе 88 (59%) женщин и 62 (41%) мужчины, а также 32 человека без признаков ХП (условно здоровые люди). Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен Межвузовским комитетом по этике (протокол № 06-17 от 15.06.2017).Возраст обследованных составлял 18–73 года. Пациенты с ХП были разделены на 2 группы по пародонтальным критериям: 1-я группа — ХП средней степени тяжести, 2-я группа — ХП тяжёлой степени с тенденцией к прогрессированию. Пациенты 2-й группы имели рентгенологические признаки выраженной резорбции альвеол челюстных костей.
Для подтверждения диагноза пародонтита проводили мультиплексную полимеразную цепную реакцию (ПЦР) с использованием набора реагентов «МультиДент-5» (НПФ «ГенЛаб») для выявления P. gingivalis, Prevotella intermedia, Tannerella forsythia, Treponema denticola, Aggregatibacter actinomycetemcomitans, а также ПЦР с обратной транскрипцией для F. alocis и P. gingivalis в содержимом пародонтального кармана.
Клетки, несущие маркеры CD282 и СD284, выявляли в смывах десневой жидкости из пародонтального кармана или зубодесневой борозды раствором Хенкса. Выделенные клетки окрашивали антителами к маркерам CD282 (соответствует рецептору TLR2) или СD284 (соответствует рецептору TLR4), меченными FITC, и фиксировали параформальдегидом. Готовые препараты просматривали под микроскопом «ECLIPSE 50i» («Nicon») при увеличении ×1000.
Фенотип лейкоцитов периферической крови определяли с помощью метода проточной лазерной цитофлуориметрии [17]. Для этого к 100 мкл крови добавляли по 10 мкл раствора антител, меченных флюоресцентными многоцветными красителями против TLR2 (TLR2 IgG1 — FITC), CD14 — PE, CD45 — PerCP, CD19 — APC, CD3 — AF700 или TLR4 (TLR4 IgG1 — FITC) и CD14 — PE, CD45 — PerCP, CD19 — APC, CD3 — AF700. В пробирки с негативным контролем добавляли мышиные антитела, меченные FITC (IgG1 — FITC), а также антитела, меченные PE, PerCP, APC и AlexaFluor 700. Инкубировали 30 мин в темноте при 4°С. Для удаления эритроцитов использовали лизирующий буфер FACSLyse («BDBioscience») в объёме 2 мл в течение 10 мин при комнатной температуре в темноте. Затем проводили центрифугирование при 500g в течение 5 мин. Надосадочную жидкость удаляли. К осаждённым клеткам добавляли по 2 мл фосфатно-солевого буфера. Клеточную взвесь дважды отмывали центрифугированием, после чего лейкоциты ресуспендировали и добавляли 0,5 мл фиксирующего буфера FACS CellFix («BD Bioscience»). Полученные пробы исследовали на проточном цитометре «FACSCanto 2», определяя экспрессию TLR2 и TLR4 на основных субпопуляциях CD3+-Т-лимфоцитов, CD19+-В-лимфоцитов, CD14+-моноцитах и CD45dim-гранулоцитах.
Вероятность различия исследуемых показателей оценивали с помощью критерия t Стьюдента. Все расчёты проводили с помощью пакета программ «Statistica 7.0».
Результаты
Результаты молекулярно-биологического исследования, проведённого с помощью ПЦР, показали, что из 150 пациентов с ХП ДНК P. gingivalis выявили у 94 (62,7%), F. alocis — у 97 (64,7%), в то время как представители других пародонтопатогенов встречались менее чем у 50% пациентов (табл. 1). У 11 (7,3%) пациентов представители данных пародонтопатогенных видов не обнаружены. В контрольной группе частота выявления пародонтопатогенных видов не превышала 8,6% для P. intermedia и 11,4% для F. alocis и T. forsythia. Представители A. actinomycetemcomitans, P. gingivalis, T. denticola у пациентов с интактным пародонтом не обнаружены.
Таблица 1. Частота выявления пародонтопатогенных видов бактерий в материале из биоплёнки у больных ХП и пациентов с интактным пародонтом (%)
Table 1. Frequency of detection of periodontal pathogenic bacterial species in biofilm material in patients with chronic periodontal disease and intact periodontium (%)
Виды пародонтопатогенных бактерий Types of periodontopathogenic bacteria | Группа | Group | χ2 | |
пациенты с ХП patients with chronic periodontal disease (n = 150) | пациенты со здоровым пародонтом patients with healthy periodontium (n = 35) | ||
A. actinomycetemcomitans | 69* (46,0) | 0 (0) | 25,677 |
F. alocis | 97* (64,7) | 4 (11,4) | 32,447 |
P. gingivalis | 94* (62,7) | 0 (0) | 44,590 |
P. intermedia | 72* (48,0) | 3 (8,6) | 18,302 |
T. forsythia | 73* (48,7) | 4 (11,4) | 17,256 |
T. denticola | 52* (34,6) | 0 (0) | 16,877 |
Нет бактерий | No germs | 11* (7,3) | 29 (82,9) | 95,515 |
Примечание. *р < 0,001 по сравнению с пациентами со здоровым пародонтом.
Note. *p < 0.001 compared with the patients with healthy periodontium.
Как показали параллельные исследования десневой жидкости у здоровых обследуемых или экссудата пародонтального кармана у пациентов с ХП, проведённые с помощью иммунофлюоресцентной микроскопии, большую часть клеток составляли лейкоциты, которые экспрессировали рецепторы врождённого иммунитета TLR2 и TLR4 с различной интенсивностью.
В контрольной группе частота выявления клеток, экспрессирующих эти маркеры, составила 12,3 ± 3,2%, а в группе пациентов с ХП в фазе обострения — 4,1 ± 2,1% (p < 0,05).
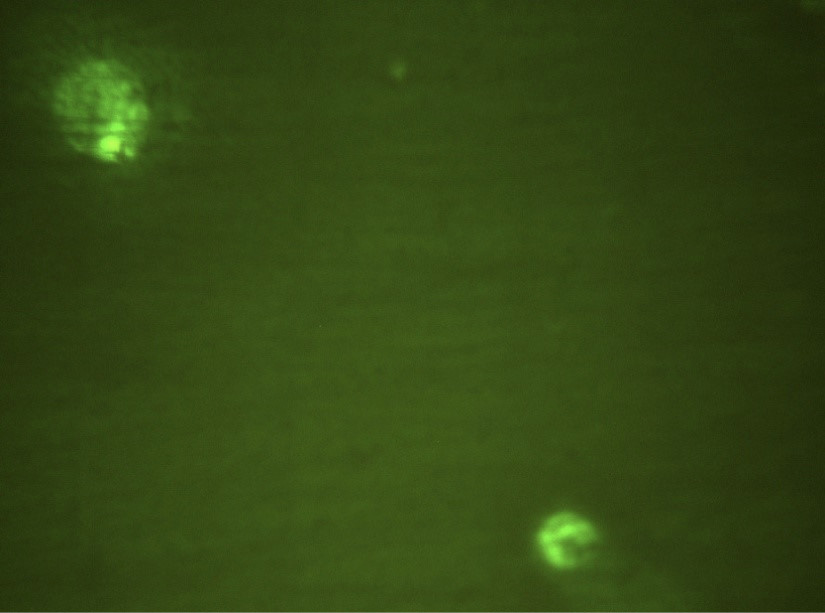
На рис. 1 в поле зрения люминесцентного микроскопа зафиксированы 2 клетки, экспрессирующие CD282 (TLR2), меченные FITC. Видны ярко окрашенные скопления в виде гранул. На рис. 2 в фазовом контрасте видны 4 клетки, выделенные из экссудата пародонтального кармана. На рис. 3 при люминисцентном микроскопировании представлены эти же 4 клетки с неярким диффузным окрашиванием CD284-FITC (TLR4). Таким образом, в результате данного пилотного исследования выявлена и визуализирована экспрессия рецепторов врождённого иммунитета TLR2 и TLR4 в десневой жидкости и экссудате пародонтального кармана при ХП.
Рис. 1. Клетки десневой жидкости, экспрессирующие CD282. Окраска FITC, ×1000.
Рис. 2. Клетки десневой жидкости. Фазовый контраст, ×1000.
Рис. 3. Клетки десневой жидкости, экспрессирующие CD284. Окраска FITC, ×1000.
К сожалению, содержание клеточных элементов в десневой жидкости было меньше, чем требуется для исследования иммунофенотипа клеток на проточном цитометре — 3,5–9,4 × 106 клеток/мл [17]. При выделении клеток из десневой жидкости обычно используют её смывы изотоническим раствором NaCl, которые позволяют получить 5–10 × 103 клеток/мл, т.е. примерно в 2 раза меньше, чем требуется. Поэтому для получения дополнительных данных проводили исследования на клетках периферической крови.
В первой серии экспериментов определяли экспрессию TLR2 и TLR4 на лейкоцитах, выделенных из периферической крови пациентов с помощью осаждения эритроцитов на 2% желатине в фосфатно-солевом буфере, согласно стандартным методикам, применяемым для определения фенотипа иммунокомпетентных клеток [8].
Полученные данные позволяют утверждать, что экспрессия TLR2 и TLR4 на лейкоцитах периферической крови у разных людей независимо от группы, к которой они принадлежали, значительно варьировала от полного отсутствия до 100% экспрессии на моноцитах крови некоторых людей. На рис. 4 и рис. 5 представлены примеры определения маркеров CD14/CD282 и CD3/CD284 на нейтрофилах, лимфоцитах и моноцитах периферической крови.
Рис. 4. Экспрессия TLR2 на лейкоцитах периферической крови. Здесь и на рис. 5: а — график переднего и бокового светорассеяния: нейтрофилы — область, окрашенная в зелёный цвет, лимфоциты — участки красного цвета, моноциты — синего цвета; б–г — двумерный точечный график — экспрессия СD14, CD282 и CD14/CD282 на клетках разных популяций лейкоцитов.
Рис. 5. Экспрессия TLR4 на лейкоцитах периферической крови.
Экспрессия TLR2 на моноцитах (двойное окрашивание CD14/CD282) и TLR4 на лимфоцитах (двойное окрашивание CD3/CD284) была очень низкой и не превышала 1%.
Во второй серии экспериментов клетки цельной крови одновременно окрашивали с помощью нескольких антител против определённых популяций лейкоцитов, меченных различными флюоресцентными метками. В данной модификации иммунофенотипирования клетки субпопуляций не теряются, что обычно происходит при выделении лейкомассы из периферической крови. Тем не менее доля клеток, экспрессирующих CD282 (TLR2), также была невысокой.
Наиболее высокий уровень экспрессии маркеров CD282 (TLR2) наблюдали на лимфоцитах людей со здоровым пародонтом (табл. 2). У пациентов 1-й группы относительное и абсолютное содержание лимфоцитов, экспрессирующих CD282, было в 3 раза ниже, чем у представителей контрольной группы. У пациентов 2-й группы относительное содержание лимфоцитов, экспрессирующих CD282, было ниже в 4 раза, чем у представителей контрольной группы, а абсолютное — в 5,7 раза.
Таблица 2. Экспрессия CD282 (TLR2) на лейкоцитах периферической крови
Table 2. Expression of CD282 (TLR2) on peripheral blood leukocytes
Группа | Group | Экспрессия CD282 (TLR2) | Expression of CD282 (TLR2) | |||
лимфоциты lymphocytes | моноциты monocytes | нейтрофилы neutrophils | ||
Пациенты со здоровым пародонтом Patients with healthy periodontium | % | 1,06 ± 0,45 | 0,65 ± 0,11 | 0,34 ± 0,04 |
абс., 106/л | abs. 106/liter | 56,24 ± 24,12 | 34,45 ± 5,71 | 18,15 ± 2,16 | |
1-я | 1st | % | 0,35 ± 0,01* | 0,91 ± 0,43* | 0,12 ± 0,01* |
абс., 106/л | abs. 106/liter | 18,82 ± 0,93* | 43,72 ± 5,34* | 6,13 ± 0,93* | |
2-я | 2nd | % | 0,26 ± 0,05* | 0,065 ± 0,028 | 0,08 ± 0,01* |
абс., 106/л | abs. 106/liter | 9,91 ± 1,91* | 2,48 ± 1,12* | 2,67 ± 3,05* | |
Примечание. *р < 0,05 по сравнению с пациентами со здоровым пародонтом.
Note. *p < 0.05 compared with the patients with healthy periodontium.
Экспрессия CD282 на моноцитах периферической крови у пациентов 2-й группы была в 1,4 раза выше, чем у людей в контрольной группе. Тем не менее у пациентов 2-й группы относительное количество моноцитов, экспрессирующих TLR2, было в 10 раз меньше, чем в контрольной группе, а абсолютное содержание — в 13,9 раза меньше.
На нейтрофилах экспрессия CD282 была ещё ниже. Так, у пациентов 1-й группы относительное и абсолютное содержание было меньше, чем в контрольной группе, в 2,8 и 3,0 раза, а у больных 2-й группы — в 4,3 и 6,8 раза.
Экспрессия CD284 (TLR4) на лейкоцитах периферической крови у обследованных пациентов имела такой же характер, хотя на лимфоцитах пациентов 1-й группы этих рецепторов было в 2,8 и 2,9 раза больше, чем в контрольной группе. У пациентов 2-й группы относительное содержание CD284+-лимфоцитов было выше, чем у людей со здоровым пародонтом, только в 1,2 раза, а абсолютное количество — в 1,14 раза ниже (табл. 3).
Таблица 3. Экспрессия CD284 (TLR4) на лейкоцитах периферической крови
Table 3. Expression of CD284 (TLR4) on peripheral blood leukocytes
Группа | Group | Экспрессия CD284 (TLR4) | Expression of CD284 (TLR4) | |||
лимфоциты lymphocytes | моноциты monocytes | нейтрофилы neutrophils | ||
Пациенты со здоровым пародонтом Patients with healthy periodontium | % | 0,26 ± 0,12 | 0,145 ± 0,003 | 0,35 ± 0,05 |
абс., 106/л | abs. 106/liter | 13,52 ± 6,50 | 7,63 ± 1,51 | 18,25 ± 3,11 | |
1-я | 1st | % | 0,73 ± 0,13* | 2,17 ± 0,18* | 0,275 ± 0,083* |
абс., 106/л | abs. 106/liter | 39,06 ± 2,79* | 117,02 ± 3,8* | 14,79 ± 1,78 | |
2-я | 2nd | % | 0,31 ± 0,11 | 0,09 ± 0,04* | 0,21 ± 0,07* |
абс., 106/л | abs. 106/liter | 11,81 ± 4,19* | 3,39 ± 2,67* | 8,05 ± 2,67* | |
Примечание. *р < 0,05 по сравнению с пациентами со здоровым пародонтом.
Note. *p < 0.05 compared with the patients with healthy periodontium.
На моноцитах самая высокая экспрессия CD284 была также у пациентов 1-й группы с ХП средней степени тяжести — в 15 раз больше, чем у пациентов контрольной группы. Самая низкая экспрессия — у пациентов 2-й группы с ХП тяжёлой степени и признаками резорбции челюстных костей — относительное количество в 1,7 раза меньше, а абсолютное — в 2,3 раза меньше, чем у представителей контрольной группы.
На нейтрофилах самая высокая экспрессия CD284 была в крови у людей контрольной группы; у пациентов 1-й группы относительное количество было ниже, чем в контрольной группе, в 1,3 раза, абсолютное — в 1,2 раза, а у пациентов 2-й группы относительное количество было ниже в 1,7 раза и абсолютное — в 2,3 раза (табл. 3). Следует отметить, что у пациентов 1-й группы относительное количество нейтрофилов, экспрессирующих TLR2, было в 1,5 раза выше, чем у пациентов 2-й группы, моноцитов — в 15 раз и лимфоцитов — в 1,3 раза. Разница в абсолютном содержании была ещё больше: в 2,3, 17,6 и 1,9 раза соответственно. Относительное количество нейтрофилов, экспрессирующих TLR4, у пациентов 1-й группы было выше, чем у пациентов 2-й группы, в 1,3 раза, моноцитов — в 25,5 раза, лимфоцитов — в 2,3 раза. Разница в абсолютном содержании также была выше: в 1,84, 34,5 и 3,3 раза соответственно.
Обсуждение
В результате проведённых исследований установлено, что у пациентов с ХП, ассоциированным с доминированием анаэробных возбудителей P. gingivalis и F. alocis, основные популяции лейкоцитов периферической крови (нейтрофилы, моноциты и лимфоциты) отличаются по выраженности экспрессии TLR2 и TLR4. У людей со здоровым пародонтом самая высокая экспрессия TLR2 наблюдается на лимфоцитах, в меньшей степени — на моноцитах и самая низкая — на нейтрофилах периферической крови. У них больше всего было выявлено нейтрофилов с TLR4, в меньшем количестве — лимфоцитов и ещё в меньшем — моноцитов.
Напротив, у пациентов с ХП экспрессия TLR2 была выше на моноцитах, но ниже — на нейтрофилах и лимфоцитах по сравнению с контролем; экспрессия TLR4 выше на моноцитах и лимфоцитах, но ниже на нейтрофилах.
Полученные результаты свидетельствуют о возможной зависимости данного феномена от прогрессирования заболевания пародонта, на что указывает большая выраженность костно-резорбтивных процессов у пациентов с ХП тяжёлой степени. Экспрессия TLR2 на всех изучаемых популяциях лейкоцитов у пациентов с ХП, ассоциированным с выраженной резорбцией альвеолярной кости, была ниже, чем у здоровых людей, в 4–14 раз и в 1,3–15 раза, чем у больных пародонтитом, без выраженного прогрессирования. Экспрессия TLR4 у этих пациентов также была ниже в 1,2–2,3 раза, чем у здоровых людей, и в 1,3–25,5 раза ниже по сравнению с экспрессией TLR на лейкоцитах больных ХП средней степени тяжести без прогрессирования.
Выводы
- Уровень экспрессии TLR2 и TLR4 принципиально не отличается на нестимулированных клетках периферической крови (нейтрофилах, моноцитах и лимфоцитах) и десневой жидкости у людей со здоровым пародонтом, но варьирует при развитии ХП.
- У больных с ХП средней и тяжёлой степени в фазе обострения, ассоциированным с представителями пародонтопатогенной микробиоты, преимущественно gingivalis и F. alocis, выявлена разнонаправленная экспрессия рецепторов TLR2 и TLR4 на клетках периферической крови — в сторону как увеличения, так и уменьшения.
- Достоверно более низкие показатели экспрессии маркеров TLR2 и TLR4 на клетках периферической крови наблюдали при ХП тяжёлой степени, который сопровождался признаками костной резорбции челюстных костей, что позволяет сделать предположение о том, что изменения в системе врождённого иммунитета, проявляющиеся на уровне экспрессии TLR, связаны с системной потерей минеральной плотности костной ткани и прогрессированием ХП.
Об авторах
Виктор Николаевич Царев
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Автор, ответственный за переписку.
Email: nikola777@rambler.ru
ORCID iD: 0000-0002-3311-0367
д.м.н., профессор, зав. каф. микробиологии, вирусологии, иммунологии
Россия, МоскваЕлена Николаевна Николаева
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Email: nikola777@rambler.ru
ORCID iD: 0000-0002-7854-3262
д.м.н., профессор, г.н.с. лаб. молекулярно-биологических исследований
Россия, МоскваЕвгений Валерьевич Ипполитов
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Email: nikola777@rambler.ru
ORCID iD: 0000-0003-1737-0887
д.м.н., профессор, с.н.с. лаб. молекулярно-биологических исследований
Россия, МоскваТатьяна Викторовна Царева
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Email: nikola777@rambler.ru
ORCID iD: 0000-0001-9571-0520
к.м.н., доцент кафедры микробиологии, вирусологии, иммунологии
Россия, МоскваМихаил Сергеевич Подпорин
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Email: nikola777@rambler.ru
ORCID iD: 0000-0001-6785-0016
к.м.н., н.с. лаб. молекулярно-биологических исследований
Россия, МоскваИрина Петровна Балмасова
Московский государственный медико-стоматологический университет им. А.И. Евдокимова; Российский университет дружбы народов
Email: nikola777@rambler.ru
ORCID iD: 0000-0001-8194-2419
д.м.н., профессор, зав. лаб. патогенеза и методов лечения инфекционных заболеваний
Россия, Москва; МоскваСписок литературы
- Carrion J., Scisci E., Miles B., Sabino G.J., Zeituni A.E., Gu Y., et al. Microbial carriage state of peripheral blood dendritic cells (DCs) in chronic periodontitis influences DC differentiation, atherogenic potential. J. Immunol. 2012; 189(6): 3178–87. https://doi.org/10.4049/jimmunol.1201053
- Darveau R.P., Pham T.T., Lemley K., Reife R.A., Bainbridge B.W., Coats S.R., et al. Porphyromonas gingivalis lipopolysaccharide contains multiple lipid A species that functionally interact with both toll-like receptors 2 and 4. Infect. Immun. 2004; 72(9): 5041–51. https://doi.org/10.1128/iai.72.9.5041-5051.2004
- Mathews J.B., Wright H.J., Roberts A., Cooper P.R., Chapple I.L. Hyperactivity and reactivity of peripheral blood neutrophils in chronic periodontitis. Clin. Exp. Immunol. 2007; 147(2): 255–64. https://doi.org/10.1111/j.1365-2249.2006.03276.x
- Moutsopoulos N.M., Konkel J.E. Tissue specific immunity at the oral mucosal barrier. Trends Immunol. 2018; 39(4): 276–87. https://doi.org/10.1016/j.it.2017.08.005
- Murakami T. Understanding and treatment strategy of the pathogenesis of periodontal disease based on chronic inflammation. Clin. Calcium. 2016; 26(5): 766–72. (in Japanese)
- Papadopoulos G., Shaik-Dasthagirisaheb Y.B., Huang N., Viglianti G.A., Henderson A.J., Kantarci A., et al. Immunologic environment influences macrophage response to Porphyromonas gingivalis. Mol. Oral. Microbiol. 2017; 32(3): 250–61. https://doi.org/10.1111/omi.12168
- Wilensky A., Chaushu S., Shapira L. The role of natural killer cells in periodontitis. Periodontol. 2000. 2015; 69(1): 128–41. https://doi.org/10.1111/prd.12092
- Burns E., Bachrach G., Shapira L., Nussbaum G. Cutting Edge: TLR2 is required for the innate response to Porphyromonas gingivalis: activation leads to bacterial persistence and TLR2 deficiency attenuates induced alveolar bone resorption. J. Immunol. 2006; 177(12): 8296–300. https://doi.org/10.4049/jimmunol.177.12.8296
- Jia L., Han N., Du J., Guo L., Luo Z., Liu Y. Pathogenesis of important virulence factors of Porphyromonas gingivalis via toll-like receptors. Front. Cell. Infect. Microbiol. 2019; (9): 262. https://doi.org/10.3389/fcimb.2019.00262
- Krauss J.L., Potempa J., Lambris J.D., Hajishengallis G. Complementary Tolls in the periodontium: how periodontal bacteria modify complement and Toll-like receptor responses to prevail in the host. Periodontol. 2000. 2010; 52(1): 141–62. https://doi.org/10.1111/j.1600-0757.2009.00324.x
- Mukherjee S., Huda S., Sinha Babu S.P. Toll-like receptor polymorphism in host immune response to infectious diseases: a review. Scand. J. Immunol. 2019; 90(1): e12771. https://doi.org/10.1111/sji.12771
- Nichols F.C., Yao X., Bajrami B., Downes J., Finegold S.M., Knee E., et al. Phosphorylated dihydroceramides from common human bacteria are recovered in human tissues. PLoS One. 2011; 6(2): e16771. https://doi.org/10.1371/journal.pone.0016771
- Trejo-de la O.A., Hernández-Sancén P., Maldonado-Bernal C. Relevance of single-nucleotide polymorphisms in human TLR genes to infectious and inflammatory diseases and cancer. Genes Immun. 2014; 15(4): 199–209. https://doi.org/10.1038/gene.2014.10
- Байракова А.Л., Воропаева Е.А., Афанасьев С.С., Алешкин В.А., Несвижский Ю.В., Караулов А.В. и др. Роль и биологическое значение Толл-подобных рецепторов в антиинфекционной резистентности организма. Вестник Российской академии медицинских наук. 2008; (1): 45–54.
- Бондаренко В.М., Гинцбург А.Л., Лиходед В.Г. Роль инфекционного фактора в патогенезе атеросклероза. Эпидемиология и инфекционные болезни. 2011; (1): 7–11.
- Koren O., Spor A., Felin J., Fåk F., Stombaugh J., Tremaroli V., et al. Human oral, gut, and plaque microbiota in patients with atherosclerosis. Proc. Natl Acad. Sci. USA. 2011; 108(Suppl. 1): 4592–8. https://doi.org/10.1073/pnas.1011383107
- Хаитов Р.М., Пинегин Б.В., Ярилин А.А. Руководство по клинической иммунологии: диагностика заболеваний иммунной системы. М.: ГЭОТАР-Медиа; 2009.
Дополнительные файлы