Условно-патогенная микробиота грудного молока и антимикробная активность сыворотки на разных сроках лактации
- Авторы: Арзуманян В.Г.1, Колыганова Т.И.1,2, Вартанова Н.О.1, Ожован И.М.1, Кравцова Е.О.2, Зверев В.В.1,2
-
Учреждения:
- Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
- Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
- Выпуск: Том 100, № 1 (2023)
- Страницы: 74-83
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/1333
- DOI: https://doi.org/10.36233/0372-9311-352
- ID: 1333
Цитировать
Полный текст
Аннотация
Цель: оценка взаимосвязи между количеством условно-патогенных микроорганизмов в грудном молоке и антимикробной активностью (АМА) сыворотки на разных сроках лактации.
Материалы и методы. Из 100 образцов грудного молока от здоровых кормящих матерей производили посевы на плотные селективные среды, затем чистые культуры микроорганизмов идентифицировали методом MALDI-TOF масс-спектрометрии. АМА сыворотки оценивали методом спектрофотометрии по отношению к модельной культуре Candida albicans.
Результаты. Получено 270 изолятов, представленных 36 видами 13 родов условно-патогенных бактерий. Ни один образец из 100 не содержал условно-патогенных грибов. Преобладающими явились стафилококки (7 видов) и стрептококки (11 видов). Наиболее часто встречались стафилококки — S. epidermidis (70,2%), S. aureus (20,8%) и стрептококки — S. mitis (27,7%) и S. oralis (21,8%). Общая обсеменённость (медиана) условно-патогенными бактериями молозива составила 7–9 × 103 КОЕ/мл, переходного молока — 4 × 103 КОЕ/мл, зрелого молока — 5 × 102 КОЕ/мл. АМА сыворотки молозива составляла 87,4–89,4%, переходного молока — 88,2%, зрелого молока — 63,4–81,9%. Общая обсеменённость имела высокую обратную корреляцию с периодом лактации (r = –0,806) и высокую прямую корреляцию с АМА сыворотки (r = 0,699). При этом значимое снижение обсеменённости отмечено после 1 мес от начала лактации, тогда как значимое снижение АМА — после 8 мес.
Заключение. Установлено, что снижение общей обсеменённости грудного молока условно-патогенными бактериями по мере увеличения срока лактации первично по отношению к снижению АМА сыворотки. Таким образом, изменение факторов антимикробной защиты сыворотки грудного молока происходит в ответ на изменение объёма условно-патогенной микробиоты.
Ключевые слова
Полный текст
Введение
Грудное молоко (ГМ) является не только оптимальным источником питательных веществ для младенца, но и защищает его от инфекций с помощью набора антимикробных субстанций — иммуноглобулинов и антимикробных пептидов [1]. Ранее ГМ считали стерильной жидкостью, однако оказалось, что оно содержит множество родов/видов микроорганизмов. Сегодня можно считать доказанным, что микробиом ГМ и его метаболиты обеспечивают не только нормальное развитие кишечной микробиоты младенца, но и его иммунную защиту [2–6]. В связи с подтверждёнными преимуществами, которые даёт микробиом ГМ, его наличие стали считать физиологической нормой. Есть мнение, что кишечная микробиота ребёнка формируется из микробиоты матери, в частности, населяющей кожу, молочные протоки и, более того, кишечник [7]. Показано, что дендритные клетки регулярно нарушают интестинальный эпителий, захватывая живые бактерии и доставляя их в мезентериальные лимфатические узлы, откуда они затем через лимфатическую систему попадают в дистальные участки тела. Обращает на себя внимание тот факт, что разнообразие бактерий, населяющих кишечник младенца, невелико: очевидно, что передача микробиоты из кишечника матери с лимфотоком касается не всех видов микроорганизмов [8].
С помощью традиционных культуральных методов и молекулярных методик, позволяющих идентифицировать бактериальную ДНК, определены следующие классы бактерий:
- Firmicutes: Staphylococcus, Streptococcus, Veillonella, Gemella, Enterococcus, Clostridia, Bifidobacterium, Lactobacillus;
- Actinobacteria: Propionibacterium, Actinomyces, Corynebacterium;
- Proteobacteria: Pseudomonas, Sphingomonas, Serratia, Escherichia, Enterobacter, Ralstonia, Bradyrhizobium;
- Bacteroidetes: Prevotella [9].
Этот список постоянно обновляется, причём установлено также наличие вирусов и микромицетов [7]. Наиболее часто встречающимися в ГМ микроорганизмами являются стафилококки, в частности Staphylococcus epidermidis, и стрептококки [7, 10, 11]. Распространённость такой типичной для ГМ группы бактерий, как лактобациллы, значительно варьирует, тогда как обилие и распространённость бифидобактерий довольно низкие.
В процессе лактации состав микробиома ГМ меняется. Установлено, что общая биомасса бактерий в молозиве ниже, чем в переходном и зрелом молоке, но видовое разнообразие выше [12, 13]. Показано, что уровни типичных энтеробактерий, таких как Bifidobacterium spp. и Enterococcus spp., повышаются с увеличением срока лактации, что, по мнению авторов, подтверждает продолжающуюся транслокацию бактерий из гастроинтестинального тракта матери [13, 14].
Ранее нами установлено, что по мере увеличения периода лактации антимикробная активность (АМА) сыворотки ГМ значительно снижалась [15], что было обусловлено снижением уровней секреторного иммуноглобулина класса А (sIgA), лактоферрина и сывороточного альбумина [16].
Целью настоящей работы явилась оценка взаимосвязи между наличием/концентрацией условно-патогенных микроорганизмов ГМ и АМА сыворотки на разных сроках лактации.
Материалы и методы
Образцы ГМ получали от 100 здоровых кормящих матерей на разном сроке лактации (возрасте ребёнка). Перед сцеживанием ГМ сосок и ареолу обрабатывали мыльным раствором и промывали теплой водой. ГМ собирали в стерильный одноразовый контейнер и в течение 1 ч доставляли в лабораторию, где производили посевы на чашки Петри с плотными селективными средами: питательная среда № 10 ГРМ для выделения стафилококков с добавлением яичного желтка (ГНЦ ПМБ, Оболенск); агар Эндо-ГРМ для выделения энтеробактерий (ГНЦ ПМБ, Оболенск); питательная среда № 2 ГРМ, Сабуро, для выделения грибов (ГНЦ ПМБ, Оболенск); питательный ГРМ-агар (ГНЦ ПМБ, Оболенск) с добавлением 5% стерильной дефибринированной лошадиной крови (ЗАО «Эколаб»); UriSelect 4 для выделения уропатогенных бактерий («Bio-Rad»). Посевы инкубировали 1–2 сут при 37ºС в аэробных и анаэробных условиях.
Далее путём пересевов получали чистые культуры микроорганизмов. Идентификацию чистых культур микроорганизмов проводили с помощью MALDI-TOF масс-спектрометрии на приборе «MALDI Biotyper Sirius RUO System» («Bruker»). Для этого одну изолированную колонию свежей чистой культуры микроорганизмов наносили одноразовой микробиологической петлёй на лунку мишени специальной пластины (MSP-чипа). Сразу после высыхания биомассы мишени обрабатывали 1–2 мкл 70% муравьиной кислоты для экстракции микробных белков. Далее на мишени наносили 1–2 мкл матрицы (альфа-циано-4-гидроксикоричной кислоты в водном растворе ацетонитрила и трифторуксусной кислоты) для ионизации микробных пептидов, после чего пластину помещали в прибор и проводили МС-идентификацию. Результат идентификации считали достоверным, если коэффициент соответствия с базой данных (Score) был более или равен 2,0. Для более точной дифференциации Streptococcus pneumoniae от S. mitis и S. oralis ставили оптохиновый тест и делали микроскопию мазков, окрашенных по Граму. Score не менее 2,0, положительный оптохиновый тест и наличие ланцетовидных диплококков давали основание считать, что изолят относится к S. pneumoniae.
При получении сыворотки 1,5 мл размороженного ГМ центрифугировали со скоростью 16 000 об/мин в течение 5 мин, собирали нижнюю фракцию, не содержащую жиров, и к ней добавляли аликвоту раствора лимонной кислоты для удаления казеина [1]. После инкубации при комнатной температуре в течение 5 мин смесь центрифугировали со скоростью 16 000 об/мин в течение 10 мин, а полученный супернатант (сыворотку) использовали для определения АМА.
АМА сыворотки оценивали методом спектрофотометрии по отношению к модельной культуре Candida albicans [17]. Для этого 300 мкл сыворотки (опыт) или 300 мкл физиологического раствора (контроль) соединяли с 50 мкл суспензии клеток Candida albicans № 927 (коллекция НИИВС им. И.И. Мечникова), полученной из расчёта 1 микробиологическая петля в 50 мкл. Суспензию инкубировали при 32ºС в течение 2 ч на шейкере, центрифугировали 5 мин при 16 000 об/мин, супернатанты удаляли, а к осадкам добавляли по 300 мкл раствора бромкрезолового пурпурного в фосфатном буфере (рН 4,6). После этого пробы инкубировали при 32ºС в течение 45 мин на шейкере и центрифугировали в том же режиме. Осадки микроскопировали при суммарном увеличении 1750 («ЛОМО») и фотографировали цифровой камерой «Sony», а по 50 мкл супернатантов соединяли с 2,5 мл фосфатного буфера рН 4,6 и измеряли оптическую плотность (ОП) полученных на спектрофотометре «Genesys 10S UV-Vis» при длине волны 440 нм. Активность рассчитывали как разность ОП между контрольным и опытным образцом, отнесённую к ОП контрольного образца и выраженную в процентах.
Статистический анализ проводили с помощью программы «Microsoft Excel 2019».
Результаты
В настоящем исследовании не ставилась цель определить все виды микроорганизмов, присутствующие в ГМ, а только те, которые являются условно-патогенными. Ни один образец из 100 не содержал условно-патогенных грибов.
Таблица 1. Видовое разнообразие изолятов, полученных из 100 образцов ГМ
Table 1. Species diversity of isolates obtained from 100 samples of breast milk
Роды Genus | Виды Species | Число изолятов Number of isolates |
Staphylococcus | S. epidermidis | 71 |
S. aureus | 21 | |
S. haemolyticus | 13 | |
S. lugdunensis | 9 | |
S. hominis | 9 | |
S. warneri | 5 | |
S. pasteuri | 1 | |
Streptococcus | S. mitis | 28 |
S. oralis | 22 | |
S. parasanguinis | 20 | |
S. vestibularis | 13 | |
S. salivarius | 11 | |
S. pneumoniae | 5 | |
S. peroris | 1 | |
S. agalactiae | 1 | |
S. pseudopneumoniae | 1 | |
S. constellatus | 1 | |
S. infantis | 1 | |
Enterococcus | Enterococcus sp. | 2 |
Bacillus | B. subtilis | 2 |
Enterobacter | E. cloaceae | 1 |
Escherichia | E. coli | 1 |
Corynebacterium | Corynebacterium sp. | 2 |
С. tuberculostearicum | 2 | |
C. argentoratense | 1 | |
Klebsiella | K. oxytoca | 2 |
K. pneumoniae | 1 | |
Paenibacillus | P. amylolyticus | 1 |
Rothia | Rothia sp. | 3 |
R. mucilaginosa | 2 | |
Neisseria | N. subflava | 4 |
N. flavescens | 2 | |
Neisseria sp. | 1 | |
Kocuria | K. kristinae | 1 |
Gemella | G. haemolysans | 7 |
Gemella sp. | 1 | |
Итого родов — 13 Total genus — 13 | Итого видов — 36 Total species — 36 | Итого изолятов — 270 Total isolates — 270 |
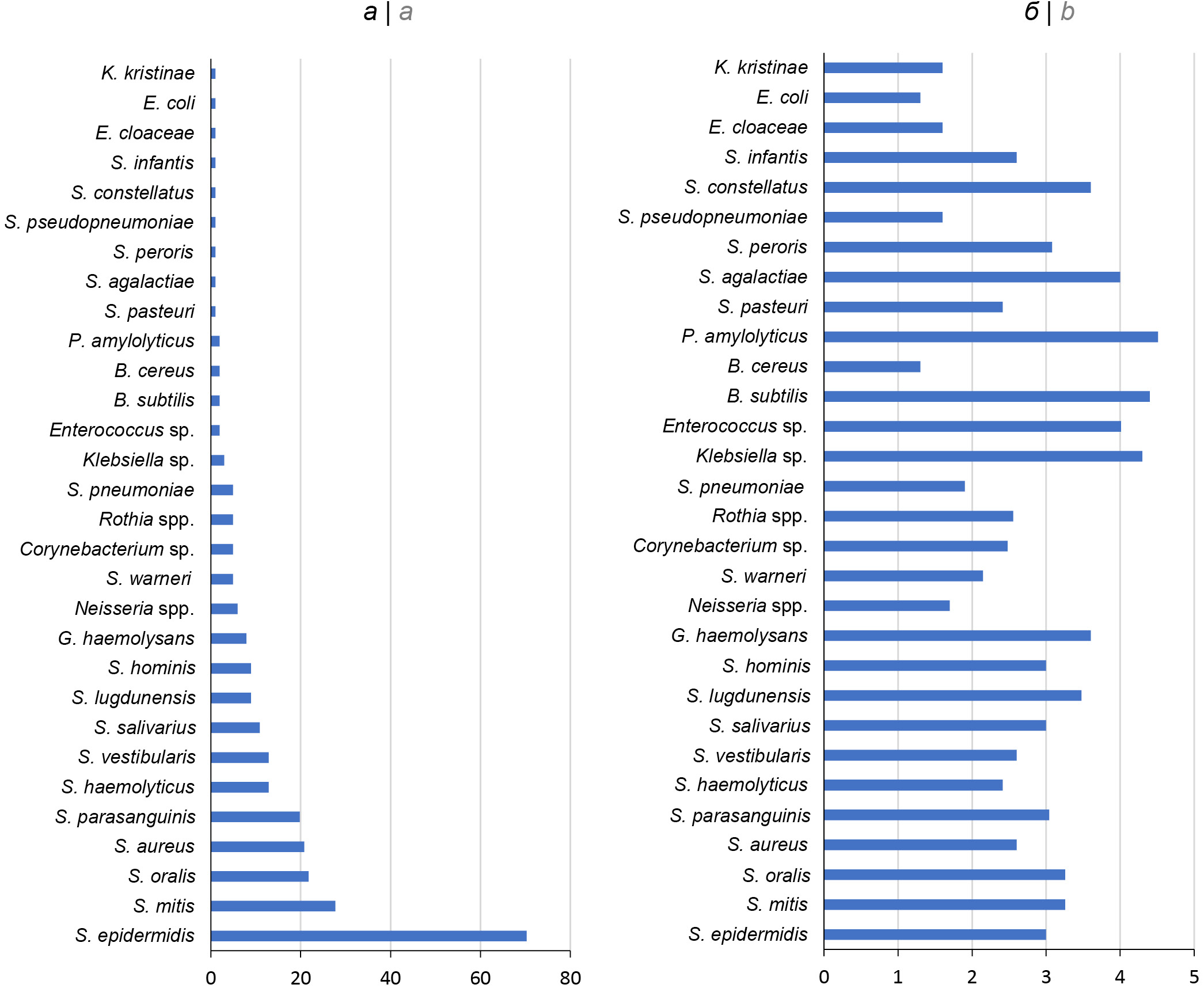
В табл. 1 указаны виды условно-патогенных бактерий, выделенных из 100 образцов ГМ: 270 изолятов представлены 36 видами 13 родов. Преобладающими являются стафилококки (7 видов) и стрептококки (11 видов). Наиболее часто (свыше 20%) встречаются стафилококки — S. epidermidis, S. aureus и стрептококки — S. mitis и S. oralis (рисунок, а). Остальные роды бактерий представлены 1–3 видами, причём некоторые из полученных изолятов, такие как Enterococcus sр., Corynebacterium sp., Rothia sp., Neisseria sp. и Gemella sp., не удалось идентифицировать до уровня вида, даже применив такой современный метод, как MALDI-TOF масс-спектрометрия. Обращает на себя внимание тот факт, что обсеменённость ГМ стафилококками и стрептококками варьировала от 102 до 103 КОЕ/мл, тогда как максимальная биомасса бактерий (104 КОЕ/мл и выше) характерна для редко встречающихся видов, таких как P. amylolyticus, B. subtilis и др. (рисунок, б).
Микробиом ГМ здоровых женщин. а — частота встречаемости условно-патогенных микроорганизмов в целом по всей выборке, %; б — обсеменённость (медиана), log (КОЕ/мл).
Microbiome of the healthy women’s breast milk. а — prevalence of opportunistic microorganisms in the whole sample, %; b — contamination (median), log (CFU/ml).
В табл. 2 представлены данные, касающиеся взаимосвязи между периодом лактации, АМА сыворотки и наличием микроорганизмов в ГМ. Образцы ГМ были разделены на группы в соответствии с периодом лактации: 1-я группа — 1–2-суточное молозиво; 2-я — 3-суточное молозиво; 3-я — переходное ГМ 4 сут – 1 мес; 4-я — зрелое ГМ 3–8 мес; 5-я — зрелое ГМ старше 9 мес. Для каждого периода лактации определены и рассчитаны следующие показатели: АМА сыворотки, частота встречаемости и обсеменённость наиболее значимыми видами, суммарная обсеменённость образцов в данной группе и их видовое разнообразие.
Таблица 2. Взаимосвязь между периодом лактации, АМА сыворотки и наличием микроорганизмов в ГМ
Table 2. The interaction between the lactation period, antimicrobial activity of milk whey and the presence of microorganisms in breast milk
N | Период лактации Lactation period | Период лактации, мес (медиана) Lactation period, months (median) | АМ активность, % (медиана) AM activity, % (median) | S. epidermidis | S. mitis | S. oralis | S. aureus | Суммарная обсеменённость, КОЕ/мл (медиана) The amount of contamination, CFU/ml (median) | Видовое разнообразие, ٪ Species diversity, % | ||||
частота встречаемости, % рrevalence, % | КОЕ/мл, (медиана) CFU/ml, (median) | частота встречаемости, % рrevalence, % | КОЕ/мл, (медиана) CFU/ml, (median) | частота встречаемости, % рrevalence, % | КОЕ/мл, (медиана) CFU/ml, (median) | частота встречаемости, % рrevalence, % | КОЕ/мл, (медиана) CFU/ml, (median) | ||||||
11 | 1–2 сут | 1–2 days | 0,07 | 87,4 | 81,8 | 1200 | 36,4 | 6000 | 75 | 3000 | 9,1 | 200 | 9200 | 43,3 |
38 | 3 сут | 3 days | 0,1 | 89,4 | 73,7 | 2000 | 31,6 | 4000 | 31,6 | 1800 | 29 | 400 | 6800 | 76,7 |
13 | 4 сут – 1 мес 4 days – 1 month | 0,13 | 88,2 | 69,2 | 1000 | 23,1 | 1000 | 23,1 | 4000 | 38,5 | 100 | 4200 | 60 |
19 | 3–8 мес | 3–8 months | 6 | 81,9 | 68,4 | 500 | 21,1 | 150 | 21,1 | 0 | 5,3 | 2000 | 560 | 50 |
19 | 9–27 мес 9–27 months | 13 | 63,4 | 57,9 | 90 | 26,3 | 60 | 26,3 | 210 | 15,8 | 80 | 460 | 53,3 |
Корреляция с периодом лактации, r Correlation with the lactation period, r | – | –0,977 | –0,854 | –0,838 | –0,400 | –0,674 | –0,397 | –0,785 | –0,413 | 0,127 | –0,806 | –0,283 | |
Корреляция с АМА, r Correlation with the activity, r | –0,977 | – | 0,827 | 0,810 | 0,272 | 0,581 | 0,288 | 0,664 | 0,336 | 0,079 | 0,699 | 0,291 | |
Установлено, что АМА сыворотки обратно пропорциональна периоду лактации, на что указывают отрицательное высокое значение коэффициента корреляции и значимые различия величин активности 1-й и 5-й групп (р < 0,001). Частота встречаемости и обсеменённость S. epidermidis обратно коррелировали с периодом лактации (табл. 2), но были прямо пропорциональны АМА сывороток. Та же закономерность, но менее выраженная, имела место для S. mitis и S. oralis. Исключение среди часто встречающихся видов составлял S. aureus. Другими словами, первые 3 вида преобладали в раннем молозиве, тогда как S. aureus — в переходном молоке.
Среди видов, не относящихся к стафилококкам и стрептококкам, преобладал G. haemolysans, причём он встречался только в молозиве. Количество образцов с максимальной суммарной обсеменённостью — выше 104 КОЕ/мл в 1-й группе составило 54,5%, во 2-й — 42,1%, в 3-й — 23,1%, в 4-й — 10,5%, в 5-й — 5,3%. Суммарная микробная обсеменённость ГМ, оценённая в виде медиан по группам, имела высокую обратную корреляцию с периодом лактации и высокую прямую корреляцию с АМА сыворотки (табл. 2). При этом наиболее значимое снижение обсеменённости отмечено при переходе от 3-й группы к 4-й (после 1 мес лактации), тогда как наиболее значимое снижение активности имело место позже — при переходе от 4-й к 5-й группе (после 8 мес лактации). Другими словами, снижение обсеменённости было первично по отношению к снижению активности.
Видовое разнообразие, оценённое для каждой группы в целом, имело наименьшее значение в 1-й группе, а наибольшее — во 2-й, далее оно постепенно снижалось по мере увеличения срока лактации. При этом число видов, выделенных из каждого конкретного образца, варьировало от 1 до 5 в 1-й группе (медиана равна 3, среднее значение 2,8), от 1 до 5 — во 2-й (3 и 3,2), от 1 до 4 — в 3-й (3 и 2,9), от 0 до 3 — в 4-й (2 и 1,7), от 1 до 5 — в 5-й (2 и 2,5). Коэффициент корреляции между этим показателем (медианами) и медианами обсеменённости в группах составил 0,888; а между этим показателем и медианами АМА — 0,794.
Между общей обсеменённостью и возрастом матери имела место обратная корреляция высокой силы (r = –0,787); тогда как корреляция между АМА сыворотки и возрастом матери практически отсутствовала (r = –0,333).
Обсуждение
Грудное вскармливание считают гарантом защиты младенца от инфекционной диареи, что связывают с присутствием в ГМ секреторных антител, лактоферрина и прочих факторов защиты [18]. Ранее ГМ считалось стерильным субстратом, но в 2003 г. R. Martin и соавт., используя культуральные методы, показали наличие в нем молочнокислых бактерий [19]. С тех пор проведено немало исследований как традиционными, так и молекулярными методами, и показано, что в ГМ встречается свыше 1000 видов бактерий, грибов и вирусов [20, 21]. Однако есть мнение, что обнаружение в этой биожидкости многих видов типичных обитателей воды и почвы может быть связано с их наличием в используемых для анализа реагентах, растворах и наборах. Показано, однако, что так называемый «core», т.е. основу микробиома ГМ, составляют роды Staphylococcus, Streptococcus, Lactobacillus и Propionibacterium [22], а по обилию и видовому разнообразию первые два значительно превосходят остальные роды [23]. По этой причине молочнокислые и пропионовые бактерии не были включены в настоящее исследование, а основной целью данной работы явилась оценка условно-патогенной микробиоты ГМ на разных сроках лактации во взаимосвязи со способностью данного субстрата противостоять микробным агентам.
Культуральный метод учёта микроорганизмов позволяет оценить количество жизнеспособных клеток, а применяемый метод идентификации — MALDI-TOF спектрометрия — расширяет спектр идентифицируемого микробиома. Полученные нами данные о видовом составе ГМ во многом согласуются с данными других авторов. В частности, наиболее часто встречающимся видом оказался S. epidermidis, который является маркёром, отличающим микробиом кишечника младенцев, находящихся на грудном и на искусственном вскармлива- нии [24]. В то же время этот вид бактерий населяет здоровую кожу человека [25], поэтому вполне понятен источник его в ГМ. Такой вид стафилококков, как S. aureus, тоже часто встречается на коже человека в норме — показано его наличие у 30,8% людей без клинических симптомов кожных заболеваний [26]. Некоторые виды стрептококков, а также Gemella spp. и Rothia spp. считают нормальными обитателями полости рта, поэтому они могут попасть в ГМ непосредственно от младенца [27]. Однако возможен и обратный перенос, поскольку эти микроорганизмы обнаруживали в дородовых выделениях из молочных желёз [28]. В пользу этого свидетельствует обнаруженное в данном исследовании присутствие G. haemolysans именно в 1–3-суточном молозиве.
Данные по обсеменённости ГМ условно-патогенными микроорганизмами в разные периоды лактации несколько противоречивы. Например, показано, что общее количество микроорганизмов в молозиве составляло 104–105 КОЕ/мл, тогда как в зрелом и переходном молоке оно было примерно на порядок выше [29]. При этом стрептококки и стафилококки составляли по 103–104 КОЕ/мл и практически не менялись с увеличением срока лактации. Напротив, в другой работе показано, что стафилококки и стрептококки наряду с некоторыми другими видами занимали бóльшую часть микробиома молозива, тогда как их содержание в переходном и зрелом молоке было значительно ниже [30]. Оба этих исследования проведены молекулярными методами. В настоящем исследовании показано, что по мере увеличения срока лактации падает не только содержание жизнеспособных клеток стафилококков и стрептококков, но и общая биомасса условно-патогенных бактерий. В то же время видовое разнообразие в молозиве в целом несколько выше, чем в переходном и зрелом молоке, что согласуется с данными других авторов [7]. Обращает на себя внимание тот факт, что раннее молозиво (1–2-е сутки) по видовому разнообразию беднее, чем 3-суточное молозиво.
Ранее нами показано, что АМА сыворотки была максимальной в начале лактации, но по мере увеличения периода лактации значимо снижалась, коррелируя с концентрациями sIgA, лактоферрина и сывороточного альбумина, которые составляют наибольший противомикробный потенциал сыворотки [16]. В работе Р. Mastromarino и соавт. показано, что содержание основного антимикробного пептида ГМ — лактоферрина — не коррелировало с содержанием бифидо- и лактобактерий: уровень лактоферрина снижался при переходе от молозива к зрелому молоку, тогда как концентрация нормальной микрофлоры оставалась на том же уровне — 102 КОЕ/мл лактобацилл и 103 КОЕ/мл бифидобактерий [31]. Данные о взаимосвязи sIgA и микробиоты представлены лишь исследованиями микробиома кишечника новорождённых, но не микробиома ГМ [32].
Снижение АМА сыворотки подтверждено и в настоящем исследовании, при этом установлено, что общая обсеменённость молока условно-патогенными микроорганизмами и их видовое разнообразие также уменьшались в указанный период. При этом значимое снижение обсеменённости отмечено после 1 мес от начала лактации, тогда как значимое снижение АМА — после 8 мес. То есть изменение факторов антимикробной защиты сыворотки ГМ происходит в ответ на изменение биомассы условно-патогенной микробиоты. Подобных исследований в доступной литературе не обнаружено. Причиной первичного снижения биомассы условно-патогенных бактерий могут быть как их конкурентные взаимоотношения с нормобиотическими видами, так и растущий объём производимого ГМ при переходе к зрелому молоку.
Об авторах
Вера Георгиевна Арзуманян
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
Email: veraar@mail.ru
ORCID iD: 0000-0001-9769-1634
д.б.н., профессор, зав. лаб. физиологии грибов и бактерий
Россия, Россия 105064, Москва, Малый Казенный переулок, д.5аТатьяна Игоревна Колыганова
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова; Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: kolyganova_t_i@staff.sechenov.ru
ORCID iD: 0000-0002-9065-9786
ассистент кафедры микробиологии, вирусологии и иммунологии Первого МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва, Россия; м.н.с. НИИ вакцин и сывороток им. И.И. Мечникова
Россия, 119991, г. Москва, ул. Трубецкая, д. 8, стр. 2; 105064, Москва, Малый Казенный переулок, д.5аНунэ Оганесовна Вартанова
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
Email: labmicr@mail.ru
ORCID iD: 0000-0002-6372-9910
к.б.н., с.н.с.
105064, Москва, Малый Казенный переулок, д.5аИрина Михайловна Ожован
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
Email: iroj@yandex.ru
ORCID iD: 0000-0002-8129-0817
к.б.н., с.н.с.
Россия, 105064, Москва, Малый Казенный переулок, д.5аЕлена Олеговна Кравцова
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: elenakravtsova@yandex.ru
ORCID iD: 0000-0002-9100-0422
к.м.н., доцент каф. микробиологии, вирусологии и иммунологии
Россия, 119991, г. Москва, ул. Трубецкая, д. 8, стр. 2Виталий Васильевич Зверев
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова; Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Автор, ответственный за переписку.
Email: vitalyzverev@outlook.com
ORCID iD: 0000-0001-5808-2246
д.б.н., профессор, академик РАН, научный руководитель
119991, г. Москва, ул. Трубецкая, д. 8, стр. 2; 105064, Москва, Малый Казенный переулок, д.5аСписок литературы
- Колыганова Т.И., Арзуманян В.Г., Хорошко Н.В., Зверев В.В. Различия гуморальных факторов иммунной защиты грудного молока и молозива. Вопросы детской диетологии. 2021; (19): 1–8. https://doi.org/10.20953/1727–5784-2021-2-33-40
- Martín V., Maldonado-Barragán A., Moles L., Rodriguez-Baños M., Campo R.D., Fernández L., et al. Sharing of bacterial strains between breast milk and infant feces. J. Hum. Lact. 2012; 28(1): 36–44. https://doi.org/10.1177/0890334411424729
- Thompson A.L., Monteagudo-Mera A., Cadenas M.B., Lampl M.L., Azcarate-Peril M.A. Milk- and solid-feeding practices and daycare attendance are associated with differences in bacterial diversity, predominant communities, and metabolic and immune function of the infant gut microbiome. Front. Cell Infect. Microbiol. 2015; 5: 3. https://doi.org/10.3389/fcimb.2015.00003
- Rogier E.W., Frantz A.L., Bruno M.E., Wedlund L., Cohen D.A., Stromberg A.J., et al. Secretory antibodies in breast milk promote long-term intestinal homeostasis by regulating the gut microbiota and host gene expression. Proc. Natl. Acad. Sci. USA. 2014; 111(8): 3074–9. https://doi.org/10.1073/pnas.1315792111
- Schwartz S., Friedberg I., Ivanov I.V., Davidson L.A., Goldsby J.S., Dahl D.B., et al. A metagenomic study of diet-dependent interaction between gut microbiota and host in infants reveals differences in immune response. Genome Biol. 2012; 13(4): r32. https://doi.org/10.1186/gb-2012-13-4-r32
- Praveen P., Jordan F., Priami C., Morine M.J. The role of breast-feeding in infant immune system: a systems perspective on the intestinal microbiome. Microbiome. 2015; 3: 41. https://doi.org/10.1186/s40168-015-0104-7
- Stinson L.F., Sindi A.S.M., Cheema A.S., Lai C.T., Mühlhäusler B.S., Wlodek M.E., et al. The human milk microbiome: who, what, when, where, why, and how? Nutr. Rev. 2021; 79(5): 529–43. https://doi.org/10.1093/nutrit/nuaa029
- Williams J.E., Carrothers J.M., Lackey K.A., Beatty N.F., Brooker S.L., Peterson H.K., et al. Strong multivariate relations exist among milk, oral, and fecal microbiomes in mother-infant dyads during the first six months postpartum. J. Nutr. 2019; 149(6): 902–14. https://doi.org/10.1093/jn/nxy299
- Latuga M.S., Stuebe A., Seed P.C. A review of the source and function of microbiota in breast milk. Semin. Reprod. Med. 2014; 32(1): 68–73. https://doi.org/10.1055/s-0033–1361824
- Николаева И.В., Бондаренко В.М., Фиалкина С.В., Коновалова Г.Н., Купчихина Л.А., Анохин В.А. Влияние микрофлоры матери на состав микроценоза кишечника ребенка в период грудного вскармливания. Журнал микробиологии, эпидемиологии и иммунобиологии. 2008; 85(5): 87–92.
- Sakwinska O., Bosco N. Host microbe interactions in the lactating mammary gland. Front. Microbiol. 2019; 10: 1863. https://doi.org/10.3389/fmicb.2019.01863
- Gomez-Gallego C., Garcia-Mantrana I., Salminen S., Collado M.C. The human milk microbiome and factors influencing its composition and activity. Semin. Fetal Neonatal Med. 2016; 21(6): 400–405. https://doi.org/10.1016/j.siny.2016.05.003
- Sanjulián L., Lamas A., Barreiro R., Cepeda A., Fente C.A., Regal P. Bacterial diversity of breast milk in healthy Spanish women: tvolution from birth to five years postpartum. Nutrients. 2021;13(7): 2414. https://doi.org/10.3390/nu13072414
- Drago L., Toscano M., De Grandi R., Grossi E., Padovani E.M., Peroni D.G. Microbiota network and mathematic microbe mutualism in colostrum and mature milk collected in two different geographic areas: Italy versus Burundi. ISME J. 2017; 11(4): 875–84. https://doi.org/10.1038/ismej.2016.183
- Колыганова Т.И., Арзуманян В.Г., Богданова Е.А., Зверев В.В. Альтернативные методы оценки противомикробной активности сыворотки грудного молока. Бюллетень экспериментальной биологии и медицины. 2021; 171(4): 525–8. https://doi.org/10.47056/0365-9615-2021-171-4-525-528
- Арзуманян В.Г., Колыганова Т.И., Свитич О.А., Самойликов П.В., Конаныхина С.Ю., Зайцева Т.А. и др. Вклад лактоферрина, сывороточного альбумина и секреторного иммуноглобулина класса А в актимикробную активность сыворотки грудного молока. Инфекция и иммунитет. 2022; 12(3): 519–26. https://doi.org/10.15789/2220-7619-GPO-1759
- Арзуманян В.Г., Михайлова Н.А., Артемьева Т.А., Бутовченко Л.М., Вартанова Н.О., Ерофеева Т.В. и др. Способ определения противомикробной активности цельной сыворотки и фракции её антимикробных пептидов. Патент РФ № 2686337; 2018.
- Morrow A.L., Rangel J.M. Human milk protection against infectious diarrhea: implications for prevention and clinical care. Semin. Pediatr. Infect. Dis. 2004; 15(4): 221–8. https://doi.org/10.1053/j.spid.2004.07.002
- Martin R., Langa S., Reviriego C., Jiminez E., Marin M.L., Xaus J., et al. Human milk is a source of lactic acid bacteria for the infant gut. J. Pediatr. 2003; 143: 754–8. https://doi.org/10.1016/j.jpeds.2003.09.028
- Boix-Amorós A., Puente-Sánchez F.., du Toit E., Linderborg K.M., Zhang Y., Yang B., et al. Mycobiome profiles in breast milk from healthy women depend on mode of delivery, geographic location, and interaction with bacteria. Appl. Environ. Microbiol. 2019; 85: e02994–18. https://doi.org/10.1128/aem.02994-18
- Consales A., Cerasani J., Sorrentino G., Morniroli D., Colombo L., Mosca F., et al. The hidden universe of human milk microbiome: origin, composition, determinants, role, and future perspectives. Eur. J. Pediatr. 2022; 181(5): 1811–20. https://doi.org/10.1007/s00431-022-04383-1
- Ojo-Okunola A., Nicol M., Du Toit E. Human breast milk bacteriome in health and disease. Nutrients. 2018; 10: 1643. https://doi.org/10.3390/nu10111643
- Hunt K.M., Foster J.A., Forney L.J., Schütte U.M., Beck D.L., Abdo Z., et al. Characterization of the diversity and temporal stability of bacterial communities in human milk. PLoS One. 2011; 6(6): e21313. https://doi.org/10.1371/journal.pone.0021313
- Jiménez E., Delgado S., Maldonado A., Arroyo R., Albújar M., García N., et al. Staphylococcus epidermidis: a differential trait of the fecal microbiota of breast-fed infants. BMC Microbiol. 2008; 8: 143. https://doi.org/10.1186/1471-2180-8-143
- Арзуманян В.Г., Зайцева Е.В., Кабаева Т.И., Темпер Р.М. Оценка стафилококковой и нелипофильной дрожжевой микрофлоры кожи у больных с кожной патологией при контактном способе посева. Вестник дерматологии и венерологии. 2004; (6): 3–6.
- Заборова В.А., Арзуманян В.Г., Артемьева Т.А., Бутовченко Л.М., Гуревич К.Г., Ивкина М.В. Особенности стафилококковой микрофлоры кожи у спортсменов разных специализаций. Курский научно-практический вестник «Человек и его здоровье». 2015; (1): 78–82.
- Biagi E., Aceti A., Quercia S., Beghetti I., Rampelli S., Turroni S., et al. Microbial Community Dynamics in Mother’s Milk and Infant’s Mouth and Gut in Moderately Preterm Infants. Front. Microbiol. 2018; 9: 2512. https://doi.org/10.3389/fmicb.2018.02512
- Ruiz L., Bacigalupe R., García-Carral C., Boix-Amoros A., Argüello H., Silva C.B., et al. Microbiota of human precolostrum and its potential role as a source of bacteria to the infant mouth. Sci. Rep. 2019; 9(1): 8435. https://doi.org/10.1038/s41598-019-42514-1
- Khodayar-Pardo P., Mira-Pascual L., Collado M.C., Martínez-Costa C. Impact of lactation stage, gestational age and mode of delivery on breast milk microbiota. J. Perinatol. 2014; 34(8): 599–605. https://doi.org/10.1038/jp.2014.47
- Cabrera-Rubio R., Collado M.C., Laitinen K., Salminen S., Isolauri E., Mira A. The human milk microbiome changes over lactation and is shaped by maternal weight and mode of delivery. Am. J. Clin. Nutr. 2012; 96(3): 544–51. https://doi.org/10.3945/ajcn.112.037382
- Mastromarino P., Capobianco D., Campagna G., Laforgia N., Drimaco P., Dileone A., et al. Correlation between lactoferrin and beneficial microbiota in breast milk and infant’s feces. Biometals. 2014; 27(5): 1077–86. https://doi.org/10.1007/s10534-014-9762-3
- Guo J., Ren C., Han X., Huang W., You Y., Zhan J. Role of IgA in the early-life establishment of the gut microbiota and immunity: Implications for constructing a healthy start. Gut. Microbes. 2021; 13(1): 1–21. https://doi.org/10.1080/19490976.2021.1908101
Дополнительные файлы